Αρωματική ένωση
Οι αρωματικές ενώσεις (αγγλ. aromatic compounds), επίσης γνωστές ως μονοκυκλικοί ή πολυκυκλικοί αρωματικοί υδρογονάνθρακες[1], είναι οργανικές ενώσεις που περιέχουν έναν ή/και περισσότερους αρωματικούς δακτυλίους.
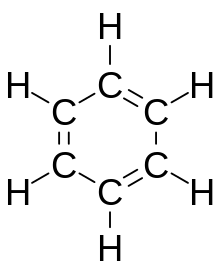
Το μητρικό μέλος των αρωματικών ενώσεων είναι η ένωση, βενζόλιο (ή βενζένιο). Η ονομασία βενζόλιο προέρχεται από την αντίστοιχη γερμανική, benzol. Η χημική έννοια "αρωματικός" προέρχεται από την πρωταρχική ομαδοποίηση των μορίων, που είχε γίνει αρχικά με βάση την οσμή τον 19ο αιώνα, πριν ακόμη γίνουν κατανοητές οι γενικές χημικές τους ιδιότητες. Ο σημερινός ορισμός των αρωματικών ενώσεων δεν έχει καμία σχέση με την οσμή τους.
Τα ετεροαρένια συνδέονται στενά, καθώς τουλάχιστον ένα άτομο άνθρακα της ομάδας CH αντικαθίσταται από ένα από τα ετεροάτομα, οξυγόνο, άζωτο ή θείο. Παραδείγματα τέτοιων ενώσεων -που δεν έχουν ως βάση το βενζόλιο- με αρωματικές ιδιότητες είναι π.χ. το φουράνιο, μια τυπική ετεροκυκλική ένωση με πενταμελή δακτύλιο, που περιλαμβάνει ένα μόνο άτομο οξυγόνου, όπως επίσης, και η πυριδίνη, μια ετεροκυκλική ένωση με έναν εξαμελή δακτύλιο ο οποίος αντί του έκτου -C, εμπεριέχει ένα άτομο αζώτου (Ν). Οι υδρογονάνθρακες χωρίς αρωματικό δακτύλιο ονομάζονται τυπικά ως αλειφατικοί.

Μοντέλο βενζολικού δακτυλίου
ΕπεξεργασίαΤο βενζόλιο (C6H6) είναι ο πιο απλός και πιο συνήθης αρωματικός υδρογονάνθρακας και -ιστορικά- υπήρξε ο πρώτος που ονομάστηκε έτσι. Η χημική φύση του βενζολίου αναγνωρίστηκε για πρώτη φορά από τον φημισμένο Γερμανό χημικό Άουγκουστ Κέκουλε τον 19ο αιώνα. Κάθε άτομο άνθρακα στον εξαγωνικό δακτύλιο -που σημειωτέον είναι και κανονικός εξαγωγικός και επίπεδος- έχει τέσσερα ηλεκτρόνια προς κοινή χρήση. Ένα ηλεκτρόνιο πηγαίνει στο άτομο υδρογόνου και ένα ηλεκτρόνιο σε καθένα από τους δύο γειτονικούς άνθρακες. Αυτό αφήνει το ένα ηλεκτρόνιο να μοιράζεται με ένα από τα δύο γειτονικά άτομα άνθρακα, δημιουργώντας έτσι έναν διπλό δεσμό με τον γειτονικό άνθρακα και αφήνοντας έναν απλό δεσμό με τον άλλο άνθρακα. Γι' αυτό ορισμένες αναπαραστάσεις του μορίου του βενζολίου το απεικονίζουν ως εξάγωνο με εναλλασσόμενο μονό δεσμό και διπλό δεσμό.
Άλλες απεικονίσεις της δομής του δείχνουν το εξάγωνο με έναν κύκλο μέσα του, για να υποδείξουν ότι τα έξι ηλεκτρόνια επιπλέουν γύρω σε μη εντοπισμένα μοριακά τροχιακά στο μέγεθος του ίδιου του δακτυλίου. Αυτό αντιπροσωπεύει την ισοδύναμη φύση των έξι δεσμών άνθρακα-άνθρακα, όλοι της τάξης δεσμού 1,5. Η ισοδυναμία αυτή εξηγείται από αυτό που στη χημεία καλείται με το όρο, δομές συντονισμού. Τα ηλεκτρόνια φαίνονται σαν να επιπλέουν πάνω και κάτω από τον δακτύλιο, με τα ηλεκτρομαγνητικά πεδία που δημιουργούν να ενεργούν για να δομούν τον δακτύλιο ως επίπεδο.
Γενικές ιδιότητες των αρωματικών υδρογονανθράκων:
- Εμφανίζουν αρωματικότητα
- Η αναλογία άνθρακα-υδρογόνου είναι υψηλή
- Καίγονται με ισχυρή αιθάλη ως κίτρινη φλόγα λόγω της υψηλής αναλογίας άνθρακα-υδρογόνου
- Υποβάλλονται σε αντιδράσεις ηλεκτροφιλικής υποκατάστασης και αρωματικές υποκαταστάσεις
Το σύμβολο του κύκλου για την αρωματικότητα εισήχθη αρχικά από τον Άγγλο χημικό Robert Robinson και τον φοιτητή του James Armit το 1925[2] και διαδόθηκε ευρέως μετά το 1959 από το εγχειρίδιο Morrison & Boyd για την Οργανική Χημεία.
Η σωστή χρήση του συμβόλου τελεί ακόμη υπό συζήτηση: ορισμένες δημοσιεύσεις το χρησιμοποιούν σε οποιοδήποτε κυκλικό σύστημα π, ενώ άλλες το χρησιμοποιούν μόνο για εκείνα τα συστήματα π που υπακούουν στον κανόνα του Hückel.
Άλλοι ερευνητές[3] υποστηρίζουν ότι, σύμφωνα με την αρχική πρόταση του Robinson, η χρήση του συμβόλου του κύκλου θα πρέπει να περιοριστεί σε μονοκυκλικά συστήματα 6 π-ηλεκτρονίων. Με αυτόν τον τρόπο το σύμβολο του κύκλου για έναν δεσμό έξι ηλεκτρονίων έξι κέντρων μπορεί να συγκριθεί με το σύμβολο Y για έναν δεσμό δύο ηλεκτρονίων τριών κέντρων.
Αντιδράσεις
ΕπεξεργασίαΕνώσεις που φέρουν αρωματικούς δακτύλιους συμμετέχουν σε πολλές οργανικές αντιδράσεις.
Αρωματική υποκατάσταση
ΕπεξεργασίαΣτην αρωματική υποκατάσταση, ένας υποκαταστάτης στον δακτύλιο αρενίου, συνήθως υδρογόνο (-Η), αντικαθίσταται από έναν άλλο υποκαταστάτη. Οι δύο κύριοι τύποι είναι η ηλεκτροφιλική αρωματική υποκατάσταση, όταν το ενεργό αντιδραστήριο είναι ηλεκτρόφιλο, και η πυρηνόφιλη αρωματική υποκατάσταση, όταν το αντιδραστήριο είναι πυρηνόφιλο.
Στη ριζική-πυρηνόφιλη αρωματική υποκατάσταση, το ενεργό αντιδραστήριο είναι μια ρίζα. Ένα παράδειγμα ηλεκτρόφιλης αρωματικής υποκατάστασης είναι η νίτρωση του σαλικυλικού οξέος:[4]
Αντιδράσεις σύζευξης
ΕπεξεργασίαΣτις αντιδράσεις σύζευξης, ένα μέταλλο καταλύει μια σύζευξη μεταξύ δύο τυπικών μερών ριζών. Οι κοινές αντιδράσεις σύζευξης με αρένια έχουν ως αποτέλεσμα το σχηματισμό νέων δεσμών άνθρακα-άνθρακα, π.χ. αλκυλαρενίων, βινυλαρενίων, μπιρυλίων, νέων δεσμών άνθρακα-αζώτου (ανιλίνες) ή νέων δεσμών άνθρακα-οξυγόνου (αρυλοξυ-ενώσεις). Ένα παράδειγμα είναι μια άμεση αρυλίωση υπερφθοροβενζολίων.[5]
Υδρογόνωση
ΕπεξεργασίαΗ υδρογόνωση των αρενίων δημιουργεί κεκορεσμένους δακτυλίους. Η χημική ένωση 1-ναφθόλη ανάγεται πλήρως σε ένα μίγμα ισομερών δεκαλινόλης.
Η ένωση ρεσορκινόλη, υδρογονωμένη με νικέλιο Raney παρουσία υδατικού υδροξειδίου του νατρίου σχηματίζει ένα ενολικό ενδιάμεσο, που αλκυλιώνεται με μεθυλοϊωδίδιο σε 2-μεθυλο-1,3-κυκλοεξανδιόνη:
Κυκλοφορτώσεις
ΕπεξεργασίαΟι αντιδράσεις κυκλικής προσθήκης δεν είναι συχνές.
Ασυνήθιστη θερμική αντιδραστικότητα Diels-Alder των αρενίων μπορεί να απαντηθεί στην αντίδραση Wagner-Jauregg. Άλλες φωτοχημικές αντιδράσεις κυκλοπροσθήκης με αλκένια συμβαίνουν μέσω διεγερτών.
Απαρωματοποίηση
ΕπεξεργασίαΣτις αντιδράσεις απαρωματοποίησης, η αρωματικότητα του αντιδρώντος συστατικού χάνεται οριστικά.
Βενζόλιο και παράγωγα αυτού
ΕπεξεργασίαΠαράγωγες ενώσεις του βενζολίου έχουν τυπικά από έναν έως έξι υποκαταστάτες που είναι συνδεδεμένοι στον κεντρικό βενζολικό δακτύλιο.
Παραδείγματα ενώσεων βενζολίου με έναν μόνο υποκαταστάτη είναι η φαινόλη, η οποία φέρει μια ομάδα υδροξυλίου, όπως και το τολουόλιο που φέρει μια ομάδα μεθυλίου. Υπάρχει βέβαια και το ξυλόλιο (αγγλ. xylene, xylol) το οποίο φέρει δύο ομάδες μεθυλίου και συνολικά έχει 3 ισομερή.
Όταν υπάρχουν περισσότεροι από ένας υποκαταστάτες στον δακτύλιο, η χωρική τους σχέση γίνεται σημαντική. Έτσι, για αυτήν καθορίζονται συγκεκριμένα μοτίβα αντικατάστασης, που φέρουν τους χαρακτηρισμούς, ortho, meta και para. Για παράδειγμα, υπάρχουν τρία ισομερή για την βενζολική ένωση, κρεσόλη, επειδή η μεθυλομάδα και η υδροξυλομάδα μπορούν να τοποθετηθούν η μία δίπλα στην άλλη (ορθοκρεσόλη, ο-κρεσόλη). Επίσης η θέση της μεθυλομάδας να μετακινηθεί στον άνθρακα -C3 (μετακρεσόλη, μ-κρεσόλη), ή ακόμα και στον άνθρακα -C4 (παρακρεσόλη, π-κρεσόλη), πάντα με το υδροξύλιο -ΟΗ να βρίσκεται στην θέση -1.
Πρόσθετα, υπάρχει και ένα άλλο παράγωγο του βενζολίου, η ξυλενόλη, η οποία φέρει δύο μεθυλομάδες επιπλέον της υδροξυλομάδας στη θέση -1. Επειδή οι δύο μεθυλικές ομάδες μπορούν να υπάρξουν χημικά σε έξι συνδυασμούς θέσεων, για αυτή το χημικό, υπάρχουν 6 διαφορετικές ισομερείς ενώσεις, με κυριότερη την 2,6-ξυλενόλη (αγγλ. 2,6-xylenol).
- Representative arene compounds
Ο δακτύλιος αρενίου δύναται να σταθεροποιεί τα φορτία. Αυτό φαίνεται, για παράδειγμα, στη φαινόλη (C6H5OH) -που είναι μακράν το κυριότερο παράγωγο του βενζολίου με σημαντικές χρήσεις σήμερα- η οποία είναι όξινη στο υδροξύλιο (-OH), καθώς ένα φορτίο σε αυτό το οξυγόνο (αλκοξείδιο –O−) μετατοπίζεται εν μέρει στον δακτύλιο του βενζολίου.
Λοιποί μονοκυκλικοί υδρογονάνθρακες
ΕπεξεργασίαΆλλοι μονοκυκλικοί αρωματικοί υδρογονάνθρακες περιλαμβάνουν το κυκλοτετραδεκαεπταένιο και τοκυκλοοκταδεκανονένιο.
Πολυκυκλικοί αρωματικοί υδρογονάνθρακες
ΕπεξεργασίαΟι πολυκυκλικοί αρωματικοί υδρογονάνθρακες (αγγλ. PAHs, στα ελληνικά, ΠΑΥ) είναι αρωματικοί υδρογονάνθρακες που αποτελούνται από συντηγμένους αρωματικούς δακτυλίους και δεν περιέχουν ετεροάτομα, ούτε και φέρουν υποκαταστάτες.[6]
Η ναφθαλίνη είναι η πιο απλή και συνηθισμένη ένωση που ανήκει στους ΠΑΥ. Πάντοτε οι ενώσεις των ΠΑΥ εμφανίζονται σε κοιτάσματα πετρελαίου και ορυκτού άνθρακα, όπως και σε παράγωγα πίσσας. Μπορεί ακόμα να παράγονται ως υποπροϊόντα της καύσης (είτε ορυκτών καυσίμων, είτε βιομάζας[7] λ.χ. ξύλου, άχυρων, κ.α.). Ως ρύποι, προκαλούν πολύ υψηλή ανησυχία, επειδή ορισμένες τέτοιες ενώσεις έχουν αναγνωριστεί και κατηγοριοποιηθεί[8] ως καρκινογόνες, μεταλλαξιογόνες ή/και τερατογόνες.
Οι ΠΑΥ ανευρίσκονται επίσης και σε μαγειρεμένα τρόφιμα. Μελέτες έχουν δείξει ότι υψηλά επίπεδα PAH ευρέθησαν για παράδειγμα, στο κρέας που μαγειρεύεται σε υψηλές θερμοκρασίες, όπως λ.χ. ψήσιμο στη σχάρα ή το μπάρμπεκιου όπως και στα καπνιστά ψάρια.[9][10][11]
Συναντώνται επίσης στο διαστρικό μέσο, στους κομήτες και στους μετεωρίτες. Στο γραφένιο απαντάται επίσης ένα παραπλήσιο μοτίβο, όπως αυτό των ενώσεων ΠΑΥ.
Δείτε επίσης
Επεξεργασία- Αρωματικοί υποκαταστάτες: αρύλιο, αρυλοξυ- και αρενεδιύλιο
- Ασφαλτένιο
- Απλοί αρωματικοί δακτύλιοι
- Οξείδιο ροδίου-πλατίνας, καταλύτης που χρησιμοποιείται για την υδρογόνωση αρωματικών ενώσεων.
Παραπομπές
Επεξεργασία- ↑ «The IUPAC Compendium of Chemical Terminology».
- ↑ Armit, James Wilkins; Robinson, Robert (1925). «Polynuclear heterocyclic aromatic types. Part II. Some anhydronium bases». J. Chem. Soc. Trans. 127: 1604–1618. doi:.
- ↑ Jensen, William B. (April 2009). «The circle symbol for aromaticity». J. Chem. Educ. 86 (4): 423–424. doi:. Bibcode: 2009JChEd..86..423J. Αρχειοθετήθηκε από το πρωτότυπο στις 2022-10-09. https://ghostarchive.org/archive/20221009/http://www.che.uc.edu/jensen/W.%20B.%20Jensen/Reprints/157.%20Aromaticity%20Circle.pdf.
- ↑ Webb, K.; Seneviratne, V. (1995). «A mild oxidation of aromatic amines». Tetrahedron Letters 36 (14): 2377–2378. doi:.
- ↑ Lafrance, M.; Rowley, C.; Woo, T.; Fagnou, K. (2006). «Catalytic intermolecular direct arylation of perfluorobenzenes.». Journal of the American Chemical Society 128 (27): 8754–8756. doi:. PMID 16819868.
- ↑ Fetzer, J. C. (2000). «The Chemistry and Analysis of the Large Polycyclic Aromatic Hydrocarbons». Polycyclic Aromatic Compounds (New York: Wiley) 27 (2): 143. doi:. ISBN 0-471-36354-5.
- ↑ Zhang, Zezhong; Ning, Shangran; Li, Qingbo; Sun, Meiling; Lin, Jianguo; Wang, Xiaofeng (2021). «Levels and risk assessment of polycyclic aromatic hydrocarbons in wood vinegars from pyrolysis of biomass». Chemosphere (Elsevier BV) 278: 130453. doi:. ISSN 0045-6535.
- ↑ «Polycyclic Aromatic Hydrocarbons (PAHs) - Public Health Statement - ATSDR». wwwn.cdc.gov. 28 Αυγούστου 2014. Ανακτήθηκε στις 4 Φεβρουαρίου 2023.
- ↑ «Polycyclic Aromatic Hydrocarbons – Occurrence in foods, dietary exposure and health effects». European Commission, Scientific Committee on Food. December 4, 2002. Αρχειοθετήθηκε από το πρωτότυπο στις 2022-10-09. https://ghostarchive.org/archive/20221009/http://ec.europa.eu/food/fs/sc/scf/out154_en.pdf.
- ↑ Larsson, B. K.; Sahlberg, GP; Eriksson, AT; Busk, LA (1983). «Polycyclic aromatic hydrocarbons in grilled food». J. Agric. Food Chem. 31 (4): 867–873. doi:. PMID 6352775.
- ↑ «Polycyclic Aromatic Hydrocarbons (PAHs)». Agency for Toxic Substances and Disease Registry. 1996. http://www.atsdr.cdc.gov/toxfaqs/tf.asp?id=121&tid=25.