Πυρηνόφιλο
Στη χημεία, ένα πυρηνόφιλο ή νουκλεόφιλο είναι ένα χημικό είδος που σχηματίζει δεσμούς δίνοντας ένα ζεύγος ηλεκτρονίων. Όλα τα μόρια και ιόντα με ελεύθερο ζεύγος ηλεκτρονίων ή τουλάχιστον έναν δεσμό π μπορούν να λειτουργήσουν ως πυρηνόφιλα. Επειδή τα πυρηνόφιλα προσφέρουν ηλεκτρόνια, είναι βάσεις Lewis. Ο όρος «Πυρηνόφιλος» περιγράφει τη συγγένεια ενός πυρηνόφιλου να συνδέεται με θετικά φορτισμένους ατομικούς πυρήνες. Η πυρηνοφιλία, που μερικές φορές αναφέρεται ως πυρηνόφιλη δύναμη, αναφέρεται στον πυρηνόφιλο χαρακτήρα μιας ουσίας και χρησιμοποιείται συχνά για τη σύγκριση της συγγένειας των ατόμων. Οι ουδέτερες πυρηνόφιλες αντιδράσεις με διαλύτες όπως οι αλκοόλες και το νερό ονομάζονται διαλυτόλυση (solvolysis). Τα πυρηνόφιλα μπορεί να συμμετέχουν στην πυρηνόφιλη υποκατάσταση (nucleophilic substitution), όπου ένα πυρηνόφιλο έλκεται από ένα πλήρες ή μερικό θετικό φορτίο, και στην πυρηνόφιλη προσθήκη (nucleophilic addition). Η πυρηνοφιλία σχετίζεται στενά με τη βασικότητα. Η διαφορά μεταξύ των δύο είναι ότι η βασικότητα είναι μια θερμοδυναμική ιδιότητα (δηλαδή σχετίζεται με μια κατάσταση ισορροπίας), αλλά η πυρηνοφιλία είναι μια κινητική ιδιότητα, η οποία σχετίζεται με ρυθμούς ορισμένων χημικών αντιδράσεων.[1]
Ιστορικό και ετυμολογία
ΕπεξεργασίαΟι όροι "πυρηνόφιλος" και "ηλεκτρόφιλος" εισήχθησαν από τον Christopher Kelk Ingold το 1933.[2] αντικαθιστώντας τους όρους «ανιονοειδές» και «κατιονοειδές» που προτάθηκαν νωρίτερα από τον Α. J. Lapworth το 1925.[3]
Ιδιότητες
ΕπεξεργασίαΓενικά, σε μια ομάδα στον περιοδικό πίνακα, όσο πιο βασικό είναι το ιόν (όσο υψηλότερο είναι το pKa του συζυγούς οξέος) τόσο πιο δραστικό είναι ως πυρηνόφιλο. Μέσα σε μια σειρά από πυρηνόφιλα με το ίδιο επιθετικό στοιχείο (π.χ. οξυγόνο), η σειρά πυρηνοφιλίας θα ακολουθεί τη βασικότητα. Το θείο είναι γενικά καλύτερο πυρηνόφιλο από το οξυγόνο.
Πυρηνοφιλία
ΕπεξεργασίαΈχουν επινοηθεί πολλά σχήματα που προσπαθούν να ποσοτικοποιήσουν τη σχετική πυρηνόφιλη ισχύ. Τα ακόλουθα εμπειρικά δεδομένα έχουν ληφθεί με τη μέτρηση του ρυθμού αντίδρασης για πολλές αντιδράσεις που περιλαμβάνουν πολλά πυρηνόφιλα και ηλεκτρόφιλα. Τα πυρηνόφιλα που εμφανίζουν το λεγόμενο φαινόμενο άλφα συνήθως παραλείπονται σε αυτόν τον τύπο αντιμετώπισης.
Εξίσωση Swain–Scott
ΕπεξεργασίαΗ πρώτη τέτοια προσπάθεια βρίσκεται στην εξίσωση Swain–Scott [4][5] από το 1953:
Αυτή η σχέση ελεύθερης ενέργειας (free-energy relationship) σχετίζεται με την ψευδο-πρώτης τάξης (pseudo first order) σταθερά ταχύτητας αντίδρασης (σε νερό στους 25°C), k, μιας αντίδρασης, κανονικοποιημένη στον ρυθμό αντίδρασης, k0, μιας τυπικής αντίδρασης με το νερό ως πυρηνόφιλο, σε μια πυρηνόφιλη σταθερά n για ένα δεδομένο πυρηνόφιλο και μια σταθερά υποστρώματος s που εξαρτάται από την ευαισθησία ενός υποστρώματος σε πυρηνόφιλη προσβολή (ορίζεται ως 1 για το μεθυλοβρωμίδιο). Αυτή η αντιμετώπιση έχει ως αποτέλεσμα τις ακόλουθες τιμές για τυπικά πυρηνόφιλα ανιόντα: οξικό 2,7, χλωρίδιο 3,0, αζίδιο 4,0, υδροξείδιο 4,2, ανιλίνη 4,5, ιωδίδιο 5,0 και θειοθειικό 6,4. Οι τυπικές σταθερές υποστρώματος είναι 0,66 για το τοσυλικό αιθύλιο, 0,77 για β-προπιολακτόνη, 1,00 για 2,3-εποξυπροπανόλη, 0,87 για βενζυλοχλωρίδιο, και 1,43 για βενζοϋλοχλωρίδιο. Η εξίσωση προβλέπει ότι, σε μια πυρηνόφιλη μετατόπιση στο βενζυλοχλωρίδιο, το ανιόν αζιδίου αντιδρά 3000 φορές πιο γρήγορα από το νερό.
Εξίσωση Ritchie
ΕπεξεργασίαΗ εξίσωση Ritchie, που προέκυψε το 1972, είναι μια άλλη σχέση ελεύθερης ενέργειας:[6][7][8]
όπου N+ είναι η παράμετρος που εξαρτάται από το πυρηνόφιλο και k0 η σταθερά ταχύτητας αντίδρασης (reaction rate constant) για το νερό. Σε αυτήν την εξίσωση, μια παράμετρος που εξαρτάται από το υπόστρωμα όπως το s στην εξίσωση Swain–Scott απουσιάζει. Η εξίσωση δηλώνει ότι δύο πυρηνόφιλα αντιδρούν με την ίδια σχετική αντιδραστικότητα ανεξάρτητα από τη φύση του ηλεκτρόφιλου, η οποία παραβιάζει την αρχή της αντιδραστικότητας-επιλεκτικότητας. Για το λόγο αυτό, αυτή η εξίσωση ονομάζεται επίσης σταθερή σχέση επιλεκτικότητας. Στην αρχική δημοσίευση τα δεδομένα ελήφθησαν από αντιδράσεις επιλεγμένων πυρηνόφιλων με επιλεγμένα ηλεκτρόφιλα καρβοκατιόντα όπως τα κατιόντα τροπυλίου (tropylium) ή διαζωνίου (diazonium):
ή (δεν εμφανίζονται) ιόντα με βάση τον πράσινο μαλαχίτη. Πολλοί άλλοι τύποι αντιδράσεων έχουν περιγραφεί έκτοτε. Οι τυπικές τιμές Ritchie N+ (σε μεθανόλη) είναι: 0,5 για τη μεθανόλη, 5,9 για το κυανιούχο ανιόν, 7,5 για το ανιόν μεθοξειδίου, 8,5 για το ανιόν αζιδίου και 10,7 για το ανιόν θειοφαινόλης. Οι τιμές για τις σχετικές αντιδραστικότητες κατιόντων είναι -0,4 για το πράσινο κατιόν του μαλαχίτη, +2,6 για το κατιόν βενζολοδιαζωνίου και +4,5 για το κατιόν τροπυλίου.
ΕξίσωσηMayr–Patz
ΕπεξεργασίαΣτην εξίσωση Mayr–Patz (1994):[9]
Η δεύτερης τάξης σταθερά ταχύτητας αντίδρασης k στους 20 °C για μια αντίδραση σχετίζεται με μια παράμετρο πυρηνοφιλίας N, μια παράμετρο ηλεκτροφιλίας E , και μια παράμετρος κλίσης που εξαρτάται από πυρηνόφιλο s. Η σταθερά s ορίζεται ως 1 με το 2-μεθυλ-1-πεντένιο ως πυρηνόφιλο. Πολλές από τις σταθερές έχουν προκύψει από την αντίδραση των λεγόμενων ιόντων βενζυδρυλίου (benzhydrylium ions) ως ηλεκτρονιόφιλων (ηλεκτρόφιλων):[10]
και μια ποικιλόμορφη συλλογή π-πυρηνόφιλων:
Οι τυπικές τιμές Ε είναι +6,2 για R = χλώριο, +5,90 για R = υδρογόνο, 0 για R = μεθόξυ ομάδα και −7,02 για R = διμεθυλαμίνη. Οι τυπικές τιμές N με s σε παρένθεση είναι -4,47 (1,32) για ηλεκτρόφιλη αρωματική υποκατάσταση σε τολουόλιο (1), −0,41 (1,12) για ηλεκτρονιόφιλη προσθήκη σε 1-φαινυλ-2- προπένιο (2) και 0,96 (1) για προσθήκη σε 2-μεθυλ-1-πεντένιο (3), -0,13 (1,21) για αντίδραση με τριφαινυλαλυλσιλάνιο (4), 3,61 (1,11) για αντίδραση με 2-μεθυλφουράνιο (5), +7,48 (0,89) για αντίδραση με ισοβουτενυλοτριβουτυλοκασσιτερίνη (6) και +13,36 (0,81) για αντίδραση με την εναμίνη 7.[11] Το εύρος των οργανικών αντιδράσεων περιλαμβάνει επίσης αντιδράσεις SN2:[12]
Με E = -9,15 για το ιόν S-μεθυλοδιβενζοθειοφαινίου, οι τυπικές τιμές πυρηνόφιλου N (s) είναι 15,63 (0,64) για πιπεριδίνη, 10,49 (0,68) για μεθοξείδιο και 5,20 (0,89). ) για το νερό. Εν ολίγοις, οι πυρηνοφιλία προς τα κέντρα sp2 ή sp3 ακολουθούν το ίδιο μοτίβο.
Ενιαία εξίσωση
ΕπεξεργασίαΣε μια προσπάθεια να ενοποιηθούν οι παραπάνω εξισώσεις, η εξίσωση Mayr ξαναγράφεται ως:[12]
με sE την παράμετρο κλίσης που εξαρτάται από το ηλεκτρονιόφιλο και sN την παράμετρο κλίσης που εξαρτάται από το πυρηνόφιλο. Αυτή η εξίσωση μπορεί να ξαναγραφτεί με διάφορους τρόπους:
- με sE = 1 για καρβοκατιόντα αυτή η εξίσωση είναι ίση με την αρχική εξίσωση Mayr–Patz του 1994,
- με sN = 0,6 για τα περισσότερα n πυρηνόφιλα η εξίσωση γίνεται
- ή η αρχική εξίσωση Scott-Swain γραμμένη ως:
- με sE = 1 για καρβοκατιόντα και sN = 0,6 η εξίσωση γίνεται:
- ή η αρχική εξίσωση Ritchie γραμμένη ως:
Τύποι
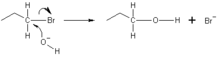
ΕπεξεργασίαΠαραδείγματα πυρηνόφιλων είναι ανιόντα όπως το Cl−, ή μια ένωση με ένα μονήρες ζεύγος ηλεκτρονίων όπως NH3 (η αμμωνία) και PR 3. Στο παρακάτω παράδειγμα, το οξυγόνο του ιόντος υδροξειδίου δίνει ένα ζεύγος ηλεκτρονίων για να σχηματίσει έναν νέο χημικό δεσμό με τον άνθρακα στο άκρο του μορίου βρωμοπροπανίου. Στη συνέχεια, ο δεσμός μεταξύ του άνθρακα και του βρωμίου υφίσταται ετερολυτική σχάση, με το άτομο του βρωμίου να παίρνει το δοσμένο ηλεκτρόνιο και να γίνεται το ιόν βρωμίου (Br−), επειδή μια αντίδραση SN2 εμφανίζεται με προσβολή από πίσω. Αυτό σημαίνει ότι το ιόν υδροξειδίου προσβάλλει το άτομο του άνθρακα από την άλλη πλευρά, ακριβώς απέναντι από το ιόν βρωμίου. Εξαιτίας αυτής της οπίσθιας προσβολής, οι αντιδράσεις SN2 έχουν ως αποτέλεσμα την αντιστροφή της διαμόρφωσης του ηλεκτρονιόφιλου. Εάν το ηλεκτρονιόφιλο είναι χειρόμορφο, διατηρεί τυπικά τη χειρομορφία του, αν και η απόλυτη διαμόρφωση του προϊόντος SN2 ανατρέπεται σε σύγκριση με εκείνη του αρχικού ηλεκτρονιόφιλου.
Αμφιδραστικά πυρηνόφιλα
ΕπεξεργασίαΈνα αμφιδραστικό πυρηνόφιλο είναι αυτό που μπορεί να προσβάλλει από δύο ή περισσότερες θέσεις, με αποτέλεσμα δύο ή περισσότερα προϊόντα. Παραδείγματος χάρη, το θειοκυανικό ιόν (SCN−) μπορεί να προσβάλλει είτε από το θείο είτε από το άζωτο. Για το λόγο αυτό, η αντίδραση SN2 ενός αλκυλαλογονιδίου με SCN− οδηγεί συχνά σε ένα μείγμα θειοκυανικού αλκυλεστέρα (R-SCN ) και ενός ισοθειοκυανικού αλκυλίου (R-NCS). Παρόμοιες εκτιμήσεις ισχύουν στη σύνθεση νιτριλίου Kolbe.
Αλογόνα
ΕπεξεργασίαΕνώ τα αλογόνα δεν είναι πυρηνόφιλα στη διατομική τους μορφή (π.χ. το I2 δεν είναι πυρηνόφιλο), τα ανιόντα τους είναι καλά πυρηνόφιλα. Σε πολικούς, πρωτικούς διαλύτες, το F− είναι το πιο αδύναμο πυρηνόφιλο και το I− το ισχυρότερο. Αυτή η σειρά αντιστρέφεται στους πολικούς, απρωτικούς διαλύτες.[13]
Άνθρακας
ΕπεξεργασίαΤα πυρηνόφιλα του άνθρακα είναι συχνά οργανομεταλλικά αντιδραστήρια όπως αυτά που βρίσκονται στην αντίδραση Grignard, στην αντίδραση Blaise, στην αντίδραση Reformatsky και στην αντίδραση Barbier, ή αντιδράσεις που περιλαμβάνουν οργανολιθικά αντιδραστήρια και ακετυλίδια. Αυτά τα αντιδραστήρια χρησιμοποιούνται συχνά για την εκτέλεση πυρηνόφιλων προσθηκών. Οι ενόλες είναι επίσης πυρηνόφιλα άνθρακα. Ο σχηματισμός μιας ενόλης καταλύεται από οξύ ή βάση. Οι ενόλες είναι αμφιδραστικά πυρηνόφιλα, αλλά, γενικά, είναι πυρηνόφιλες στο άτομο άλφα του άνθρακα. Οι ενόλες χρησιμοποιούνται συνήθως σε αντιδράσεις συμπύκνωσης, συμπεριλαμβανομένων των αντιδράσεων συμπύκνωσης Claisen και αλδόλης.
Οξυγόνο
ΕπεξεργασίαΠαραδείγματα πυρηνόφιλων οξυγόνου είναι το νερό (H2O), το ανιόν υδροξειδίου, οι αλκοόλες, τα ανιόντα αλκοξειδίου, το υπεροξείδιο του υδρογόνου και τα καρβοξυλικά ανιόντα. Η πυρηνόφιλη προσβολή δεν λαμβάνει χώρα κατά τη διάρκεια του διαμοριακού δεσμού υδρογόνου.
Θείο
ΕπεξεργασίαΑπό πυρηνόφιλα θείου, το υδρόθειο και τα άλατά του, οι θειόλες (RSH), θειολικά ανιόντα (RS−), ανιόντα θειοκαρβοξυλικών οξέων (RC(O)-S−), και ανιόντα διθειοανθρακικών (RO-C(S)-S−) και διθειοκαρβαμιδικών (R2N-C(S)-S−) χρησιμοποιούνται συχνότερα. Γενικά, «το θείο είναι πολύ πυρηνόφιλο λόγω του μεγάλου του μεγέθους», γεγονός που το καθιστά εύκολα πολώσιμο και τα μονήρη ζεύγη ηλεκτρονίων του είναι εύκολα προσβάσιμα.
Άζωτο
ΕπεξεργασίαΤα πυρηνόφιλα αζώτου περιλαμβάνουν την αμμωνία, το αζίδιο, τις αμίνες, τα νιτρώδη, την υδροξυλαμίνη, την υδραζίνη, το καρβαζίδιο, τη φαινυλυδραζίνη, ημικαρβαζίδιο και το αμίδια.
Μεταλλικά κέντρα
ΕπεξεργασίαΑν και τα μεταλλικά κέντρα (π.χ. Li+, Zn2+, Sc3+, κ.λπ.) είναι συνήθως κατιονικά και ηλεκτρονιόφιλα (όξινα κατά Lewis ) στη φύση, ορισμένα κέντρα μετάλλων (ιδιαίτερα αυτά σε κατάσταση χαμηλής οξείδωσης και/ή που φέρουν αρνητικό φορτίο) είναι από τα ισχυρότερα καταγεγραμμένα πυρηνόφιλα και μερικές φορές αναφέρονται ως «υπερπυρηνόφιλα». Παραδείγματος χάρη, χρησιμοποιώντας μεθυλοϊωδίδιο ως ηλεκτρονιόφιλο αναφοράς, το Ph3Sn– είναι περίπου 10000 φορές πιο πυρηνόφιλο από το I–, ενώ το Co( I) μορφή της βιταμίνη Β12 (βιταμίνη Β12s) είναι περίπου 107 φορές πιο πυρηνόφιλη.[14] Άλλα υπερπυρηνόφιλα μεταλλικά κέντρα περιλαμβάνουν ανιόντα μεταλλικού καρβονυλίου χαμηλής οξείδωσης (π.χ. CpFe(CO)2–).[15]
Παραδείγματα
ΕπεξεργασίαΟ παρακάτω πίνακας δείχνει την πυρηνοφιλία ορισμένων μορίων με τη μεθανόλη ως διαλύτη:[16]
| Σχετική πυρηνοφιλία | Μόρια |
|---|---|
| Πολύ καλή | I⁻, HS⁻, RS⁻ |
| Καλή | Br⁻, OH⁻, RO⁻, CN⁻, N3⁻ |
| Μέτρια | NH3, Cl⁻, F⁻, RCO2⁻ |
| Ασθενής | H2O, ROH |
| Πολύ ασθενής | RCO2H |
Παραπομπές
Επεξεργασία- ↑ Nucleophilicity—Periodic Trends and Connection to Basicity. Einar Uggerud.
- ↑ Ingold, C. K. (1933). «266. Significance of tautomerism and of the reactions of aromatic compounds in the electronic theory of organic reactions». Journal of the Chemical Society (Resumed): 1120. doi:.
- ↑ Lapworth, A. (1925). «Replaceability of Halogen Atoms by Hydrogen Atoms». Nature 115: 625. https://archive.org/details/sim_nature-uk_1925-04-25_115_2895/page/n31.
- ↑ Quantitative Correlation of Relative Rates. Comparison of Hydroxide Ion with Other Nucleophilic Reagents toward Alkyl Halides, Esters, Epoxides and Acyl Halides C. Gardner Swain, Carleton B. Scott J. Am. Chem. Soc.; 1953; 75(1); 141-147.
- ↑ «Swain–Scott equation». The IUPAC Compendium of Chemical Terminology. 2014. doi:10.1351/goldbook.S06201 .
- ↑ «Ritchie equation». The IUPAC Compendium of Chemical Terminology. 2014. doi:10.1351/goldbook.R05402 .
- ↑ Nucleophilic reactivities toward cations Calvin D. Ritchie Acc. Chem. Res.; 1972; 5(10); 348-354.
- ↑ Cation–anion combination reactions. XIII. Correlation of the reactions of nucleophiles with esters Calvin D. Ritchie J. Am. Chem. Soc.; 1975; 97(5); 1170–1179.
- ↑ Mayr, Herbert; Patz, Matthias (1994). «Scales of Nucleophilicity and Electrophilicity: A System for Ordering Polar Organic and Organometallic Reactions». Angewandte Chemie International Edition in English 33 (9): 938. doi:.
- ↑ Mayr, Herbert; Bug, Thorsten; Gotta, Matthias F; Hering, Nicole; Irrgang, Bernhard; Janker, Brigitte; Kempf, Bernhard; Loos, Robert και άλλοι. (2001). «Reference Scales for the Characterization of Cationic Electrophiles and Neutral Nucleophiles». Journal of the American Chemical Society 123 (39): 9500–12. doi:. PMID 11572670.
- ↑ An internet database for reactivity parameters maintained by the Mayr group is available at http://www.cup.uni-muenchen.de/oc/mayr/
- ↑ 12,0 12,1 Phan, Thanh Binh; Breugst, Martin; Mayr, Herbert (2006). «Towards a General Scale of Nucleophilicity?». Angewandte Chemie International Edition 45 (23): 3869–74. doi:. PMID 16646102.
- ↑ Chem 2401 Supplementary Notes. Thompson, Alison and Pincock, James, Dalhousie University Chemistry Department
- ↑ Schrauzer, G. N.; Deutsch, E.; Windgassen, R. J. (April 1968). «The nucleophilicity of vitamin B(sub 12s)» (στα αγγλικά). Journal of the American Chemical Society 90 (9): 2441–2442. doi:. ISSN 0002-7863. PMID 5642073.
- ↑ Dessy, Raymond E.; Pohl, Rudolph L.; King, R. Bruce (November 1966). «Organometallic Electrochemistry. VII. 1 The Nucleophilicities of Metallic and Metalloidal Anions Derived from Metals of Groups IV, V, VI, VII, and VIII» (στα αγγλικά). Journal of the American Chemical Society 88 (22): 5121–5124. doi:. ISSN 0002-7863.
- ↑ Ian Hunt. «Chapter 8: Nucleophiles». chem.ucalgary.ca (στα Αγγλικά). University of Calgary. Ανακτήθηκε στις 15 Απριλίου 2024.