Αιθανικός μεθυλεστέρας
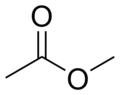
Ο αιθανικός μεθυλεστέρας ή οξικός μεθυλεστέρας είναι οργανική χημική ένωση, με μοριακό τύπο C3H6O2, αν και χρησιμοποιούνται περισσότερο οι πιο αναλυτικοί (ημισυντακτικοί) τύποι: CH3CO2CH3, CH3COOCH3 και AcOMe.
| Αιθανικός μεθυλεστέρας | |
|---|---|
| |

| |
| Γενικά | |
| Όνομα IUPAC | Αιθανικός μεθυλεστέρας |
| Άλλες ονομασίες | Οξικός μεθυλεστέρας |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C3H6O2 |
| Μοριακή μάζα | 74,08 amu |
| Σύντομος συντακτικός τύπος |
CH3COOCH3 |
| Συντομογραφίες | AcOMe |
| Αριθμός CAS | 79-20-9 |
| SMILES | O=C(OC)C |
| Αριθμός UN | W684QT396F |
| PubChem CID | 6584 |
| ChemSpider ID | 6335 |
| Ισομέρεια | |
| Ισομερή θέσης | 33 |
| Φυσικές ιδιότητες | |
| Σημείο τήξης | -98 °C |
| Σημείο βρασμού | 56,9 °C |
| Πυκνότητα | 932 kg/m3 |
| Διαλυτότητα στο νερό |
25% (20 °C) |
| Δείκτης διάθλασης , nD |
1,361 |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Eίναι ο εστέρας που παράγεται από την εστεροποίηση τουαιθανικού οξέος (CH3CO2H) και της μεθανόλης (CH3OH). Στις κανονικές συνθήκες περιβάλλοντος, δηλαδή σε θερμοκρασία 25°C και υπό πίεση 1 atm, είναι εύφλεκτο υγρό με χαρακτηριστική ευχάριστη οσμή, που μοιάζει μ' αυτές από κάποιες κόλλες ή αφαιρετικά βαψίματος νυχιών. Τα χαρακτηριστικά του είναι πολύ όμοια με εκείνα του αιθανικού αιθυλεστέρα. Χρησιμοποιείται ως διαλύτης, ελαφρά πολικός και λιπόφιλος. Είναι διαλυτός στο νερό ως τη συγκέντρωση του 25% σε θερμοκρασία δωματίου (20 °C ), αλλά, με την αύξηση της θερμοκρασίας, αυξάνεται πολύ περισσότερο. Δεν είναι σταθερός στην παρουσία ισχυρών υδατικών διαλυμάτων βάσεων ή οξέων, γιατί υδρολύεται. Δεν θεωρείται ως ΠΟΕ[1].
Δομή
Επεξεργασία| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#1',#2-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C#1-H | σ | 2sp2-1s | 106 pm | 3% C- H+ |
| C#1-C#2 | σ | 2sp2-2sp3 | 151 pm | |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C#1-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| C#1'-O | σ | 2sp3-2sp3 | 150 pm | 19% C+ O- |
| Γωνίες | ||||
| HC#1'H | 109°28' | |||
| HC#1'O | 109°28' | |||
| HC#1C#2 | 109°28' | |||
| HC#1O | 120° | |||
| C#1OO | 120° | |||
| OC#1O | 120° | |||
| COC | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[3] | ||||
| Ο (-O-) | -0,38 | |||
| Ο (=O) | -0,38 | |||
| C#2 | -0,09 | |||
| Η (HC) | +0,03 | |||
| C#1' | +0,10 | |||
| C#1 | +0,57 | |||
Παραγωγή
ΕπεξεργασίαΕστεροποίηση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας μπορεί να παραχθεί με αντίδραση εστεροποίησης μεθανόλης (CH3OH) και αιθανικού οξέος (CH3COOH) σε όξινο περιβάλλον[4][5]:
Αλκυλίωση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας μπορεί να παραχθεί με αντίδραση αλκυλίωσης αιθανικού νατρίου (CH3COONa) με μεθυλαλογονίδιο (CH3X)[6]:
Ακυλίωση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας μπορεί να παραχθεί με αντίδραση ακυλίωσης μεθανόλης (CH3OH), με τις ακόλουθες χημικές ενώσεις[7]:
1. Με ακετυλαλογονίδιο (CH3COX):
2. Με άλλον αιθανικό αλκυλεστέρα (μετεστεροποίηση, CH3COOR):
3. Με προπενόνη (CH3CH=C=O):
Χημικές ιδιότητες
ΕπεξεργασίαΣαπωνοποίηση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας δίνει αντίδραση σαπωνοποίησης με υδροξείδιο του νατρίου (NaOH), σχηματίζοντας αιθανικό νάτριο (CH3COONa) και μεθανόλη (CH3OH)[8]:
Μετεστεροποίηση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας δίνει αντίδραση μετεστεροποίησης με αλκοόλη (ROH), σχηματίζοντας αιθανικό αλκυλεστέρα και μεθανόλη[9]:
Αμμωνιόλυση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας δίνει αντίδραση αμμωνιόλυσης με αμμωνία (NH3), σχηματίζοντας αιθαναμίδιο (CH3CONH2) και μεθανόλη (CH3OH)[10]:
Αμινόλυση
ΕπεξεργασίαΠρόκειται για μια παραλλαγή της αμμωνιόλυσης, κατά την οποία χρησιμοποιείται πρωτοταγής ή δευτεροταγής αμίνη (RNH2 ή R2NH, με όχι υποχρεωτικά ίδια τα R), αντί αμμωνίας, σχηματίζοντας N-αλκυλαιθαναμίδιο (CH3CONHR) ή N,N-διαλκυλαιεθαναμίδιο (CH3CONR2), αντιστοίχως, αντί μεθαναμιδίου:[11]
Επίδραση οργανομαγνησιακών ενώσεων
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας δίνει αντίδραση επίδρασης οργανομαγνησιακών ενώσεων (RMgX), σχηματίζοντας μεθυλοκετόνη (RCOCH3) και μεθυλομαγνησιοαλογονίδιο(CH3OMgX)[12][13]:
Αναγωγή
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας δίνει αντιδράσεις οξειδοαναγωγής, σχηματίζοντας μεθανόλη (CH3OH) και αιθανόλη (CH3CH2OH)[14]:
1. Με νάτριο (Na) και αιθανόλη (CH3CH2OH):
2. Με διυδρογόνο (H2) και νικέλιο (Ni):
3. Με λιθιοαργιλιοτετραϋδρίδιο (LiAlH4):
Συμπύκνωση
ΕπεξεργασίαΟ αιθανικός μεθυλεστέρας δίνει χημική αντίδραση συμπύκνωσης με επίδραση νατρίου σε απρωτικούς διαλύτες, σχηματίζοντας βουτανοδιόνη και μεθανολικό νάτριο (CH3ONa)[15]:
Εφαρμογές
ΕπεξεργασίαΗ κύρια εφαρμογή του αιθανικού μεθυλεστέρα είναι ως ένας πτητικός και χαμηλής τοξικότητας διαλύτης για κόλλες, μπογιές και για αφαίρεση της βαφής από νύχια.
Ο αιθανικός ανυδρίτης μπορεί να παραχθεί με καρβονυλίωση του αιθανικού μεθυλεστέρα με μια διεργασία που εμπνεύσθηκε από τη σύνθεση αιθανικού οξέος Μονσάντο (Monsanto)[16].
Πηγές
Επεξεργασία- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
Αναφορές και παρατηρήσεις
Επεξεργασία- ↑ Zeno, W. Wicks, JR, Frank N. Jones, S. Peter Pappas, and Douglas A. Wicks. Organic Coatings Hoboken, New Jersey: Wiley, 2007. ISBN 978-0-471-69806-7
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ Ως μέσο οξίνισης χρησιμοποιείται συνήθως το θειικό οξύ (H2SO4), για να απορροφά το παραγόμενο νερό (H2O) και έτσι να μετακινεί το σημείο ισορροπίας της αμφίδρομης αντίδρασης προς τα δεξιά, και έτσι να την κάνει πρακτικά μονόδρομη:
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 298, §13.3Α1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 298, §13.3Α2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 298, §13.3Α3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 306, §13.7.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 306, §13.7.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 306, §13.7.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 306, §13.7.3, προσαρμογή για αμινόλυση.
- ↑ Το τελευταίο με υδρόλυση σχηματίζει μεθανόλη (CH3OH).
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 306, §13.7.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 307, §13.7.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 307, §13.7.7α.
- ↑ Zoeller, J. R.; Agreda, V. H.; Cook, S. L.; Lafferty, N. L.; Polichnowski, S. W.; Pond, D. M. (1992). «Eastman Chemical Company Acetic Anhydride Process». Catalysis Today 13: 73–91. doi:.