Χλωροσιλάνιο
Το χλωροσιλάνιο[1] (αγγλική γλώσσα:chlorosilane) είναι ανόργανη χημική ένωση, που περιέχει πυρίτιο, υδρογόνο και χλώριο, με μοριακό τύπο SiH3Cl. Είναι ένα από τα απλούστερα αλοσιλάνια. Ο όρος χλωροσιλάνιο επεκτείνεται και πέραν της «μητρικής» ένωσης, και αναφέρεται, επίσης, και σε μια ευρύτερη ομάδα «θυγατρικών» σιλανίων, ανόργανων και οργανικών, που περιέχουν έναν τουλάχιστον δεσμό Si-Cl.
| Χλωροσιλάνιο | |||
|---|---|---|---|
| |||
| |||
| Γενικά | |||
| Όνομα IUPAC | Χλωροσιλάνιο | ||
| Άλλες ονομασίες | Σιλυλοχλωρίδιο | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | SiH3Cl | ||
| Μοριακή μάζα | 66,56 amu | ||
| Συντομογραφίες | CS (= ChloroSilane) | ||
| Αριθμός CAS | 13465-78-6 | ||
| SMILES | Cl[SiH3] | ||
| InChI | 1S/ClH3Si/c1-2/h2H3 | ||
| PubChem CID | 61622 | ||
| ChemSpider ID | 55530 | ||
| Δομή | |||
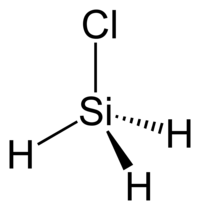
| Μοριακή γεωμετρία | τετραεδρική | ||
| Φυσικές ιδιότητες | |||
| Διαλυτότητα σε άλλους διαλύτες |
Διαλυτό σε Διαιθυλαιθέρα THF | ||
| Τάση ατμών | 3,32·10-8 | ||
| Εμφάνιση | Στερεό | ||
| Χημικές ιδιότητες | |||
| Επικινδυνότητα | |||

| |||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Σύνθεση
ΕπεξεργασίαΤα χλωροσιλάνια παράγονται με τη μέθοδο Μύλλερ-Ρότσοου (Müller-Rochow process), που περιλαμβάνει την επίδραση πυριτίου (Si) σε υδροχλώριο (HCl), σε αυξημένες θερμοκρασίες, παρουσία χαλκού ως καταλύτη. Η απλουστευμένη («ιδανική») στοιχειομετρική εξίσωση της μεθόδου είναι:
Με αυτήν τη μέθοδο το κύριο προϊόν είναι το τριχλωροσιλάνιο (SiHCl3), αλλά συμπαράγονται επίσης διχλωροσιλάνιο (SiH2Cl2) και τετραχλωροπυρίτιο (SiCl4), ως παραπροϊόντα. Η διεργασία ανακαλύφθηκε ανεξάρτητα από τους Ευτζέν Ρότσουου (Eugene G. Rochow) και Ρίτσαρντ Μύλλερ (Richard Müller) το 1940. Το χλωροσιλάνιο μπορεί να παραχθεί με επίδραση υδροχλωρίου (HCl) ή κάποιου μονοχλωραλκανίου (RCl) σε σιλάνιο (SiH4)[2]:
ή
- Συμπαράγονται και άλλα χλωροσιλάνια, ως παραπροϊόντα.
Χημεία
ΕπεξεργασίαΌλα τα χλωροσιλάνια υδρολύονται, παράγοντας υδροχλώριο και τις αντίστοιχες σιλανόλες. Η υδρόλυση του μητρικού χλωροσιλανίου αποδίδεται με την ακόλουθη στοιχειομετρική εξίσωση:
Οι τελευταίες (οι σιλανόλες δηλαδή) σχηματίζουν σταδιακά μια στερεή επιφάνεια μονοξειδίου του πυριτίου (SiO) ή αντιδρούν (μεταγενέστερα) με άλλα ισοδύναμα χλωροσιλανίου ή σιλανόλης. Σε ακόμη μεταγενέστερες φάσεις, σχηματίζονται δεσμοί της μορφής -Si-O-Si-, ανάλογοι με τους αντίστοιχους αιθερικούς δεσμούς (-C-O-C-) στις οργανικές ενώσεις, και είναι ταυτόσημοι με τους δεσμούς στο (στερεό) διοξείδιο του πυριτίου (SiO2). Ειδικά η μητρική σιλανόλη παράγει τελικά, δισιλοξάνιο:
Εφαρμογές
ΕπεξεργασίαΤα τετραχλωροπυρίτιο (SiCl4) και τριχλωροσιλάνιο (HSiCl3) είναι ενδιάμεσες ενώσεις για την παραγωγή του πυριτίου ηλεκτρονικού βαθμού καθαρότητας για τη βιομηχανία ημιαγωγών. Τα χλωροσιλάνια που παίρνονται από ακατέργαστο πυρίτιο καθαρίζονται με τεχνικές κλασματικής απόσταξης και έπειτα ανάγονται με υδρογόνο για να δώσουν πυρίτιο με καθαρότητα 99,999999999%.
Τα οργανικά χλωροσιλάνια χρησιμοποιούνται συχνά ως επικαλύψεις για επιφάνειες πυριτίου και γυαλιού και στη παραγωγή πολυμερών σιλικονών (πολυσιλοξάνια). Αν και τα φαινυλικά χλωροσιλάνια και πολλά άλλα μπορούν να χρησιμοποιηθούν, τα μεθυλοσιλοξάνια παράγονται σε μεγαλύτερες ποσότητες.
Τα μεθυλοσιλοξάνια έχουν μία μέχρι τρεις μεθυλομάδες. Στην περίπτωση του διχλωροδιμεθυλοσιλάνιου, δύο άτομα χλωρίου είναι διαθέσιμα, έτσι ώστε η αντίδραση με περίσσεια νερού να παραγάγει μια γραμμική αλυσίδα με δεσμούς παρόμοιους με αιθέρα μεταξύ των ατόμων πυριτίου. Όπως στα πολυαιθέρες, αυτοί οι εύκαμπτοι δεσμοί παράγουν ένα ελαστικό πολυμερές, το πολυδιμέθυλοσιλοξάνιο (PDMS). Το τριχλωρομεθυλοσιλάνιο μπορεί να χρησιμοποιηθεί για να επάγει διακλάδωση και διασταυρώσεις σε μόρια PDMS, ενώ το χλωροτριμεθυλοσιλάνιο χρησιμεύει για να κλείσει τις αλυσίδες του σκελετού, περιορίζοντας τη μοριακή μάζα.
Άλλα είδη σχηματισμού οξέος, ειδικά τα αιθανικό, μπορεί να αντικαταστήσει το χλώριο στη σύνθεση σιλικονών με μικρή διαφορά στη χημεία του τελικού προϊόντος. Αυτές οι αναλογίες των χλωροσιλανίων είναι αρκετά συχνές στα μονωτικά και τις κόλλες που απευθύνονται σε καταναλωτές και ως πρόδρομα για σιλικόνες ιατρικής χρήσης, λόγω της μειωμένης τοξικότητας τους.