Χλωραιθίνιο
Το αιθινυλοχλωρίδιο ή χλωροαιθίνιο ή χλωροακετυλένιο είναι η χημική ένωση με χημικό τύπο C2HCl και σύντομο συντακτικό HC≡CCl. Ανήκει στα αλκινυλοαλογονίδια, δηλαδή στα άκυκλα με ένα τριπλό δεσμό, οργανομονοαλογονίδια. Τα δυο (2) άτομα άνθρακα που περιέχει βρίσκονται σε υβριδισμό sp και συνδέονται με τριπλό δεσμό, δηλαδή ένα (1) σ και δύο (2) π.
| Χλωραιθίνιο | |
|---|---|
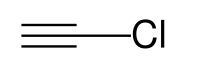
| |
| Γενικά | |
| Όνομα IUPAC | Χλωραιθίνιο Χλωροοαιθίνιο |
| Άλλες ονομασίες | Χλωροακετυλένιο |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | C2HCl |
| Μοριακή μάζα | 60,48206 amu[1] |
| Σύντομος συντακτικός τύπος |
HC ≡ CCl |
| Αριθμός CAS | 593-63-5[2] |
| SMILES | C#CCl |
| InChI | InChI=1/C2HCl/c1-2-3/h1H |
| PubChem CID | 68975 |
| Δομή | |
| Γωνία δεσμού | 180° |
| Μοριακή γεωμετρία | ευθύγραμμη |
| Ισομέρεια | |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Μοριακή δομή
Επεξεργασία| Δεσμοί | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp-1s | 92 pm | 3% C- H+ |
| C≡C | σ | 2sp-2sp | 120 pm | |
| π | 2py-2py | |||
| π | 2pz-2pz | |||
| C-Cl | σ | 2sp-2sp3 | 159 pm | 9% C+ Cl- |
Παραγωγή
ΕπεξεργασίαΜε απόσπαση υδραλογόνων
ΕπεξεργασίαΜε απόσπαση δύο μορίων υδραλογόνου από 1,1-διαλο-1-χλωροαιθάνιο ή 1,2-διαλο-1-χλωροαιθάνιο ή και 1,1-διαλο-2-χλωροαιθάνιο, με χρήση υδροξειδίου του νατρίου (NaOH), με καλύτερα αποτελέσματα αν τα άλλα αλογόνα δεν είναι φθόριο ή χλώριο, παράγεται αιθινυλοχλωρίδιο.[3]:
ή
ή
Με απόσπαση αλογόνου
ΕπεξεργασίαΜε απόσπαση δύο μορίων αλογόνου από 1,1,2,2-τετρααλο-1-χλωροαιθάνιο, με χρήση ψευδαργύρου (Zn), παράγεται αιθινυλοχλωρίδιο. Καλύτερη απόδοση αν τα άλλα αλογόνα δεν είναι φθόριο ή χλώριο[4]:
Χημικές ιδιότητες και παράγωγα
Επεξεργασία- Παρέχει δυνατότητες προσθήκης στο τριπλό του δεσμό, όσο και υποκατάστασης με το αλογόνο του, αν και το οποίο είναι το δεύτερο χειρότερο (μετά το φθόριο), για τέτοιες αντιδράσεις.
Ενυδάτωση
ΕπεξεργασίαΜε επίδραση θειικού οξέος και στη συνέχεια νερού (ενυδάτωση) σε αιθινυλοχλωρίδιο, παρουσία ιόντων υδραργύρου (Hg), παράγεται ακετυλοχλωρίδιο (CH3COCl) [5]:
- Ενδιάμεσα παράγεται 1-χλωροαιθενόλη (ασταθής ενόλη) που ισομερειώνεται προς ακετυλοχλωρίδιο.
Προσθήκη υπαλογονώδους οξέος
ΕπεξεργασίαΜε επίδραση (προσθήκη) υποαλογονώδους οξέος (HOX) σε αιθινυλοχλωρίδιο παράγεται αλοαιθανοϋλοχλωρίδιο[6]:
- Το HOX παράγεται συνήθως επιτόπου με την αντίδραση:
- Ενδιάμεσα παράγεται αλαιθενόλη (ασταθής ενόλη) που ισομερειώνεται σε αλοαιθανοϋλοχλωρίδιο.
Καταλυτική υδρογόνωση
ΕπεξεργασίαΜε καταλυτική υδρογόνωση αιθινυλοχλωρίδιου σχηματίζεται αρχικά βινυλοχλωρίδιο και στη συνέχεια (με περίσσεια υδρογόνου) αιθυλοχλωρίδιο.[7]:
Αλογόνωση
ΕπεξεργασίαΜε επίδραση αλογόνου (X2) (αλογόνωση) σε αιθινυλοχλωρίδιο έχουμε προσθήκη στον τριπλό δεσμό. Παράγεται αρχικά 1,2-διαλο-1-χλωροαιθένιο και στη συνέχεια (με περίσσεια αλογόνου) 1,1,2,2-τετρααλο-1-χλωροαιθάνιο.[8]:
Υδραλογόνωση
ΕπεξεργασίαΜε προσθήκη υδραλογόνων (HX) (υδραλογόνωση) σε αιθινυλοχλωρίδιο παράγεται αρχικά 1-αλο-1-χλωροαιθένιο και στη συνέχεια (με περίσσεια υδραλογόνου) 1,1-διαλο-1-χλωροαιθάνιο.[9]:
Υδροκυάνωση
ΕπεξεργασίαΜε προσθήκη υδροκυανίου (HCN) (υδροκυάνωση) σε αιθινυλοχλωρίδιο παράγεται 2-χλωροπροπενονιτρίλιο:
Προσθήκη μονοξειδίου του άνθρακα
Επεξεργασία1. Με προσθήκη μονοξειδίου του άνθρακα (CO) και νερού (H2O), παράγεται 2-χλωρο-2-προπενικό οξύ:
2. Με προσθήκη μονοξειδίου του άνθρακα (CO) και αλκοόλης (ROH), παράγεται 2-χλωροπροπενικός αλκυλεστέρας:
Διυδροξυλίωση
ΕπεξεργασίαΗ διυδροξυλίωση αιθινυλοχλωρίδιου, αντιστοιχεί σε προσθήκη H2O2 και παράγει υδροξυαιθανοϋλοχλωρίδιο[10]:
1. Επίδραση αραιού διαλύματος υπερμαγγανικού καλίου (KMnO4). Π.χ.:
2. Επίδραση καρβονικού οξέος και υπεροξείδιου του υδρογόνου:
- Ενδιάμεσα παράγεται 1-χλωροαιθενοδιόλη-1,2 (ασταθής ενόλη) που ισομερειώνεται σε υδροξυαιθανοϋλοχλωρίδιο.
Προσθήκη αλκοολών
ΕπεξεργασίαΜε επίδραση αλκοόλης (ROH) σε αιθινυλοχλωρίδιο παράγεται αλκυλο(1-χλωροαιθενυλο)αιθέρας[11]:
Προσθήκη καρβονικών οξέων
ΕπεξεργασίαΜε επίδραση καρβονικών οξέων (RCOOH) σε αιθινυλοχλωρίδιο παράγεται καρβονικός (1'-χλωροαιθενυλο)εστέρας[12]:
Οζονόλυση
ΕπεξεργασίαΜε επίδραση όζοντος (οζονόλυση) σε αιθινυλοχλωρίδιο, παράγεται αρχικά ασταθές οζονίδιο που τελικά διασπάται σε φορμυλομεθανοϋλοχλωρίδιο[13]:
Επίδραση πυκνού υπερμαγγανικού καλίου
ΕπεξεργασίαΜε επίδραση πυκνού διαλύματος υπερμαγγανικού καλίου (KMnO4) παράγεται χλωροφορμυλομεθανικό οξύ[14]:
Υποκατάσταση χλωρίου από υδροξύλιο
ΕπεξεργασίαΥδρόλυση με αραιό διάλυμα υδροξειδίου του νατρίου (NaOH) προς αιθενάλη (CH2=C=O)[15]:
- Ενδιάμεσα παράγεται αιθινόλη (ασταθής ινόλη) που ισομερειώνεται προς αιθενάλη.
Παραγωγή αιθέρα
ΕπεξεργασίαΜε αλκοολικά άλατα (RONa) προς αιθινυλοαλκυλολαιθέρα (HC≡COR)[15]:
Παραγωγή αλκαδιινίου
ΕπεξεργασίαΜε αλκινικά άλατα (RC≡CNa) προς αλαδιίνιο (RC≡CC≡CH). Π.χ.[15]:
Παραγωγή εστέρα
ΕπεξεργασίαΜε καρβονικά άλατα (RCOONa) προς καρβονικό αιθινυλεστέρα (RCOOC≡CH)[15]:
Παραγωγή νιτριλίου
ΕπεξεργασίαΜε κυανιούχο νάτριο (NaCN) προς προπινονιτρίλιο (ΗC≡CCN)[15]:
Παραγωγή αλκινίου
ΕπεξεργασίαΜε αλκυλολίθιο (RLi) προς αλκίνιο[15]:
Παραγωγή θειάλης
ΕπεξεργασίαΜε όξινο θειούχο νάτριο (NaSH) προς αιθενοθειάλη (CH2=C=S)[15]:
- Αρχικά παράγεται αιθινοθειόλη που ισομερειώνεται προς αιθενοθειάλη.
Παραγωγή θειαιθέρα
ΕπεξεργασίαΜε θειολικό νάτριο (RSNa) προς αιθινυλοαλκυλοθειαιθέρα (RSC≡CH)[15]:
Παραγωγή αιθινυλιωδιδίου
ΕπεξεργασίαΜε ιωδιούχο νάτριο (NaI) προς αιθινυλοοϊωδίδιο (HC≡CI)[15]:
Παραγωγή νιτροπαραγώγων
ΕπεξεργασίαΜε νιτρώδη άργυρο (AgNO2) προς νιτροαιθίνιο (ΗC≡CNO2)[16]:
Παραγωγή οργανομεταλλικών ενώσεων
Επεξεργασία1. Με λίθιο (Li). Παράγεται αιθινυλολίθιο:
2. Με μαγνήσιο (Mg) (αντιδραστήριο Grignard)[17]:
Παραγωγή αιθινυλοβενζολίου
ΕπεξεργασίαΜε αιθινυλίωση κατά Friedel-Crafts βενζολίου παράγεται αιθινυλοβενζόλιο:
Σημειώσεις και αναφορές
Επεξεργασία- ↑ Ελλείψει άλλης πηγής χρησιμοποιήθηκε: MM(βινυλοχλωρίδιου)-2AM(υδρογόνου)
- ↑ Δικτυακός τόπος SciToys
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.4.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.153, §6.3.1β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 156, §6.8.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.4α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 157, §6.8.9.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.5.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.6.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.7α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 158, §6.9.8.
- ↑ 15,0 15,1 15,2 15,3 15,4 15,5 15,6 15,7 15,8 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 186, §7.3.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244, §10.3.Α, R = HC≡C, X = Cl.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 187, §7.3.5, R = HC≡C, X = Cl.
Πηγές
Επεξεργασία- Γ. Βάρβογλη, Ν. Αλεξάνδρου, Οργανική Χημεία, Αθήνα 1972
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982