Μυρμηκικό οξύ
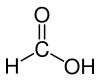
Το μυρμηκικό οξύ[1] (αγγλικά formic acid, Ε236) είναι οργανική χημική ένωση, που περιέχει άνθρακα, υδρογόνο και οξυγόνο, με μοριακό τύπο CH2O2, αν και συνηθέστερα παριστάνεται με τον ημισυντακτικό τύπο HCOOH. Είναι το απλούστερο από τα καρβοξυλικά οξέα. Είναι σημαντικό ενδιάμεσο σε χημικές συνθέσεις και υπάρχει στη φύση, περισσότερο αξιοσημείωτα στα (αμυντικά) δηλητήρια των υμενόπτερων, όπως οι μέλισσες, οι σφήκες και ιδιαιτέρως τα μυρμήγκια. Από τα τελευταία προέρχονται και τα εμπειρικά του ονόματα. Βιομηχανικά, το μυρμηκικό οξύ παράγεται από τη μεθανόλη (CH3OH).
| Μυρμηκικό οξύ | |||
|---|---|---|---|
| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Μεθανικό οξύ | ||
| Άλλες ονομασίες | Μυρμηκικό οξύ Φορμικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | CH2O2 | ||
| Μοριακή μάζα | 46,0254 ± 0,0015 amu | ||
| Σύντομος συντακτικός τύπος |
HCOOH ή HCO2H | ||
| Αριθμός CAS | 64-18-6 | ||
| SMILES | O=CO | ||
| ChemSpider ID | 278 | ||
| Κωδικός προσθέτου τροφίμων |
Ε236 | ||
| Δομή | |||
| Διπολική ροπή | 1,425 ± 0,002 (αέριο) | ||
| Μοριακή γεωμετρία | επίπεδη | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 3 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | 8,4 °C | ||
| Σημείο βρασμού | 100,8 °C | ||
| Κρίσιμη θερμοκρασία | 306,85 °C | ||
| Πυκνότητα | 1.220 kg/m³ | ||
| Διαλυτότητα στο νερό |
1.000 kg/m³ | ||
| Διαλυτότητα σε άλλους διαλύτες |
Αναμείξιμο σε Αιθανόλη Προπανόνη Διαιθυλαιθέρα | ||
| Ιξώδες | 1,57 cP στους 26 °C | ||
| Εμφάνιση | άχρωμο καυστικό υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 3,751 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
69 °C | ||
| Σημείο αυτανάφλεξης | 520 °C | ||
| Αυτοδιάσπαση | ναι | ||
| Επικινδυνότητα | |||

| |||
| Διαβρωτικό (C) | |||
| Φράσεις κινδύνου | 10, 35 | ||
| Φράσεις ασφαλείας | (1/2), 23, 26, 45 | ||
| LD50 | 700 mg/kg | ||
| MSDS | External MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το χημικά καθαρό μυρμηκικό οξύ, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι άχρωμο «ατμίζον» υγρό.
Ισομέρεια
ΕπεξεργασίαΗ ένωση έχει τρία (3) ισομερή θέσης:
- Διοξιράνιο ή επιδιοξυμεθάνιο με γραμμικό τύπο .
- Διυδροξυμεθυλιδένιο, ένα καρβένιο με ημισυντακτικό τύπο :C(OH)2.
- Υδροϋπεροξυμεθυλιδένιο, ένα καρβένιο με ημισυντακτικό τύπο :CHO2H.
Ιστορία
ΕπεξεργασίαΚάποιοι αλχημιστές και φυσιοδίφες ήξεραν από το 15ο αιώνα (το αργότερο) ότι οι μυρμηγκοφωλιές αναδίδουν έναν όξινο ατμό. Ο πρώτος που περιέγραψε μια απομόνωση του μυρμηκικού οξέος (με απόσταξη μεγάλου αριθμού μυρμηγιών) ήταν ο Άγγλος φυσιοδίφης Τζων Ραίυ (John Ray) το 1671. Τα μυρμήγκια, όπως και άλλα υμενόπτερα, εκκρίνουν το μυρμηκικό οξύ για αμυντικούς και επιθετικούς λόγους. Το μυρμηκικό οξύ πρωτοσυνθέθηκε με πρόδρομη ύλη το υδροκυάνιο (HCN), από το Γάλλο χημικό Τζόζεφ Γκαίυ - Λουσσάκ (Joseph Gay-Lussac). Το 1855, ένας άλλος Γάλλος χημικός, ο Μαρσελέν Μπερτελό (Marcellin Berthelot), ανέπτυξε τη σύνθεση μυρμηκικού οξέος από μονοξείδιο του άνθρακα (CO).
Το μυρμηκικό οξύ για μεγάλο χρονικό διάστημα θεωρούνταν μια χημική ένωση με μικρό ενδιαφέρον για τη χημική βιομηχανία. Στο τέλος της δεκαετίας του '60, ωστόσο, σημαντικές ποσότητές του έγιναν διαθέσιμες ως παραπροϊόν της παραγωγής οξικού οξέος. Από τότε υπάρχει αυξανόμενο ενδιαφέρον για χρήση ως συντηρητικό και αντιβακτηριδιακό τροφίμων, αλλά περισσότερο ζωοτροφών.
Φυσική παρουσία
ΕπεξεργασίαΣτη φύση βρίσκεται στο δηλητήριο πολλών εντόμων της τάξης των υμενοπτέρων, κυρίως στα μυρμήγκια. Επιπλέον, βρέθηκε στις τσουκνίδες. Επίσης είναι ένα σημαντικό προϊόν μερικής καύσης βενζίνης, που περιέχει ποσότητες μεθανόλης (MeOH), αιθανόλης (EtOH) ή και νερού (H2O), από κινητήρες εσωτερικής καύσης. Αποτελεί, ακόμη, ένα φυσικό συστατικό της ατμόσφαιρας της Γης, κυρίως χάρη στις εκπομπές του από τα δάση[2].
Ονοματολογία
ΕπεξεργασίαΗ ονομασία «μεθανοϊκό οξύ» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «μεθ-» δηλώνει την παρουσία ενός (1) ατόμου άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την απουσία διπλών ή και τριπλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ικό οξύ» φανερώνει ότι περιέχει ένα καρβοξύλιο (-COOH) ως κύρια χαρακτηριστική ομάδα, δηλαδή ότι πρόκειται για καρβοξυλικό οξύ.
Η ονομασία («μυρμηκικό οξύ») προέρχεται από την ελληνική λέξη «μύρμηξ» (μυρμήγκι).
Η ονομασία «φορμικό οξύ», από τη λατινική λέξη «formica» = μυρμήγκι. Στα μυρμήγκια, ωστόσο, συναντάται και στη μορφή αλάτων ή εστέρων του.
Δομή
ΕπεξεργασίαΕίναι το απλούστερο καρβοξυλικό οξύ.
| Δεσμοί[3] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp²-1s | 107 pm | 3% C- H+ |
| C=O | σ
π |
2sp²-2sp²
2p-2p |
132 pm | 19% C+ O- |
| C-O | σ | 2sp²-2s³ | 147 pm | 19% C+ O- |
| O-H | σ | 2sp³-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[4] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0,38 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C | +0,54 | |||
Παραγωγή
ΕπεξεργασίαΤο 2009 η ετήσια παγκόσμια ικανότητα παραγωγής του μυρμηκικού οξέος ήταν συνολικά (περίπου) 720.000 τόννοι, από την οποία η Ευρώπη (κυρίως η Γερμανία) είχε ετήσια ικανότητα παραγωγής (περίπου) 350.000 τόννους, η Ασία (κυρίως Κίνα) είχε ετήσια ικανότητα παραγωγής (περίπου) 370.000 τόννους, ενώ η ετήσια ικανότητα παραγωγής των υπόλοιπων ηπείρων ήταν της τάξης των μόλις 1.000 τόννων[5]. Οι μεγαλύτερες εγκαταστάσεις παραγωγής ήταν (τα στοιχεία είναι πάντα για το 2009) στο Λουντβιχσχάφεν Γερμανίας, με ετήσια ικανότητα παραγωγής 200.000 τόννους, στο Όουλου Φινλανδίας, με ετήσια ικανότητα παραγωγής 105.000 τόννους και Φέιτσεγκ Κίνας, με ετήσια ικανότητα παραγωγής 100.000 τόννους. Το 2010 οι τιμές του μυρμηκικού οξέος κυμαίνονταν από περίπου 650 €/τόννο, στη Δυτική Ευρώπη, μέχρι και 1.250 $/τόννο, στις ΗΠΑ[5].
Εμπορικά είναι διαθέσιμο σε διαλύματα με διάφορες συγκεντρώσεις που κυμαίνονται μεταξύ 85 και 99% w/w[6][7][8].
Από μυρμηκικό μεθυλεστέρα και μεθαναμίδιο
ΕπεξεργασίαΌταν συνδυάζονται μεθανόλη (CH3OH) με μονοξείδιο του άνθρακα (CO) με την παρουσία μιας ισχυρής βάσης, παράγεται μυρμηκικός μεθυλεστέρας (ΗCOOCH3), σύμφωνα με την ακόλουθη στοιχειομετρική εξίσωση[9]:
Στη βιομηχανία, αυτή η χημική αντίδραση πραγματοποιείται στην υγρή φάση υπό αυξημένη πίεση. Οι τυπικές συνθήκες είναι θερμοκρασία 80 °C και πίεση 40 atm. Η ευρύτερα χρησιμοποιούμενη βάση είναι το μεθανολικό νάτριο (CH3ONa). Η υδρόλυση του μυρμηκικού μεθυλεστέρα δίνει, στη συνέχεια, μυρμηκικό οξύ:
Για να είναι αποτελεσματική η υδρόλυση των μυρμηκικού μεθυλεστέρα απαιτείται μεγάλη περίσσεια νερού. Μερικές μέθοδοι προτιμούν την έμμεση υδρόλυση του μυρμηκικού μεθυλεστέρα, δηλαδή την αντίδρασή του πρώτα με αμμωνία (NH3), οπότε δίνει μεθαναμίδιο (HCOONH2), που με τη σειρά του υδρολύεται με τη χρήση θειικού οξέος (H2SO4):
Ένα μειονέκτημα αυτής της μεθόδου είναι η ανάγκη της διάθεσης του θειικού αμμωνίου [(NH4)2SO4], ως παραπροϊόν. Αυτό το πρόβλημα οδήγησε κάποιους παραγωγούς μυρμηκικού οξέος να αναπτύξουν πιο αποτελεσματικές, ενεργειακά, μεθόδους διαχωρισμού του μυρμηκικού οξέος, που παράγεται με τη μέθοδο της απευθείας υδρόλυσης, από τη μεγάλη περίσσεια νερού που αυτή απαιτεί. Σε αυτήν τη μέθοδο που εφαρμόστηκε από τη γερμανική BASF, το νερό απομακρύνεται από το μυρμηκικό οξύ μέσω μιας εκχύλισης υγρού-υγρού με μια οργανική βάση.
Χημικές μέθοδοι Niche
ΕπεξεργασίαΩς παραπροϊόν της παραγωγής αιθανικού οξέος
ΕπεξεργασίαΜια σημαντική ποσότητα μυρμηκικού οξέος παράγεται ως παραπροϊόν της παραγωγής άλλων χημικών προϊόντων. Κάποτε το αιθανικό οξύ παραγόταν σε μεγάλη κλίμακα με οξείδωση αλκανίων, με μια διεργασία που συμπαρήγαγε σημαντικές ποσότητες μυρμηκικού οξέος. Αυτή οξειδωτική μέθοδος, όμως, έχει φθίνουσα βιομηχανική σημασία, οπότε άλλες μέθοδοι, ειδικές στο να παράγουν μυρμηκικό οξύ, γίνονται σταδιακά όλο και πιο σημαντικές.
Υδρογόνωση διοξειδίου του άνθρακα
ΕπεξεργασίαΗ καταλυτική υδρογόνωση (Η2) του διοξειδίου του άνθρακα (CO2) σε μυρμηκικό οξύ (HCOOH) μελετήθηκε από καιρό. Αυτή η χημική αντίδραση μπορεί να πραγματοποιηθεί ομοιογενώς[10][11]
Με οξείδωση βιομάζας
ΕπεξεργασίαΤο μυρμηκικό οξύ μπορεί επίσης να ληφθεί με υδατική καταλυτική μερική οξείδωση μουλιασμένης βιομάζας (διεργασία OxFA)[12][13]. Μια τύπου Κέγκιν (Keggin) πολυοξομεταλλική ένωση (H5PV2Mo10O40) χρησιμοποιήθηκε ως ομογενής καταλύτης για να μετατρέψει σάκχαρα, ξύλο, άχρηστο χαρτί ή κυανοβακτήρια σε μυρμηκικό οξύ (HCOOH) και διοξείδιο του άνθρακα (CO2), ως μόνο παραπροϊόν. Έχει επιτευχθεί απόδοση μέχρι και 53%.
Εργαστηριακές μέθοδοι
ΕπεξεργασίαΣτο εργαστήριο, το μυρμηκικό οξύ μπορεί να ληφθεί με θέρμανση οξαλικού οξέος [(COOH)2] σε γλυκερίνη [HOCH2CH(OH)CH2OH] και μετά διαχωρισμό με απόσταξη με ατμό[14]. Η γλυκερίνη δρα ως καταλύτης, καθώς ενδιάμεσα σχηματίζει οξαλικό γλυκερυλεστέρα ως ενδιάμεση ένωση. Αν όμως το παραπάνω αναφερόμενο αντιδρών μείγμα θερμανθεί σε υψηλότερες θερμοκρασίες, παράγεται 2-προπεν-1-όλη (CH2=CHCH2OH). Η καθαρή στοιχειομετρική εξίσωση της θερμικής διάσπασης οξαλικού οξέος είναι η ακόλουθη:
Βιοσύνθεση
ΕπεξεργασίαΤο μυρμηκικό οξύ βρίσκεται ευρύτατα στη φύση με τη μορφή της συζυγούς βάσης του, δηλαδή του μυρμηκικού ανιόντος (HCOO-). Αυτό το ανιόν παράγεται με την αναγωγή του διοξειδίου του άνθρακα, που καταλύεται από το ένζυμο μυρμηκική δεϋδρογονάση. Μια δοκιμή μυρμηκικού οξέος σε σωματικά υγρά σχεδιάστηκε για τον προσδιορισμό των μυρμηκικών ανιόντων, μετά από δηλητηρίαση από μεθανόλη. Βασίστηκε στην ενζυμική αντίδραση των μυρμηκικών ανιόντων με βακτηριακή μυρμηκική δεϋδρογονάση[15].
Εναλλακτικές μέθοδοι
ΕπεξεργασίαΜε υδρόλυση υδροκυανίου ή κάποιου μυρμηκικού εστέρα
Επεξεργασία1. Με υδρόλυση υδροκυανίου (HCN) σε όξινο περιβάλλον παράγεται μυρμηκικό οξύ[16]:
2. Με υδρόλυση μυρμηκικού εστέρα (HCOOR) σε αλκαλικό περιβάλλον παράγεται μυρμηκικό οξύ[17]:
Με οξείδωση αιθενίου, μεθανόλης ή μεθανάλης
Επεξεργασία1. Με οξείδωση αιθυλενίου (CH2=CH2) παράγεται μυρμηκικό οξύ[18]:
2. Με οξείδωση μεθανόλης (CH3OH) παράγεται μυρμηκικό οξύ[19]:
3. Με οξείδωση μεθανάλης (Η2CHO) παράγεται μυρμηκικό οξύ[19]:
- Ωστόσο και το ίδιο το μυρμηκικό οξύ είναι ευαίσθητο στην τυχόν περίσσεια οξειδωτικού. Δείτε παρακάτω.
Με ειδικές μεθόδους
Επεξεργασία1. Σύνθεση με μονοξείδιο του άνθρακα (CO) και υδροξείδιο του νατρίου (NaOH)[20]:
2. Σύνθεση με μονοξείδιο του άνθρακα (CO) και μεθανόλη[21]:
ή εναλλακτικά
Φυσικές και φυσικοχημικές ιδιότητες
ΕπεξεργασίαΣτις κανονικές συνθήκες περιβάλλοντος (T = 25 °C, P = 1 atm), το χημικά καθαρό μυρμηκικό οξύ είναι ένα άχρωμο υγρό με πολύ αποπνικτική και διαπεραστική οσμή[22]. Είναι αναμείξιμο με το νερό (H2O), ευδιάλυτο με τους περισσότερους πολικούς οργανικούς διαλύτες, ακόμη και κάπως διαλυτό στους υδρογονάνθρακες. Διαλυμένο σε υδρογονάνθρακες και στην κατάσταση των ατμών του βρίσκεται κυρίως σε διμερισμένη μορφή (με δεσμούς υδρογόνου)[23]. Αυτός είναι και ο λόγος που φαίνεται ότι οι ατμοί του δεν υπακούουν στην καταστατική εξίσωση ιδανικών αερίων. Το στερεοποιημένο μυρμηκικό οξύ (που απαντιέται σε δυο πολυμορφικές δομές) αποτελείται από ουσιαστικά ατελείωτο δίκτυο πολυμερών του μέσω και πάλι δεσμών υδρογόνου. Παρουσία νερού σχηματίζει και ανάλογα συσσωματώματα μορίων με δεσμούς υδρογόνου και με τη συμμετοχή μορίων νερού. Συνέπεια αυτού είναι ότι σχηματίζει χαμηλού σημείου ζέσεως αζεοτροπικό μείγμα με το νερό, στη συγκέντρωση των 22,4%. Η σύζευξη των μορίων του στην υγρή κατάσταση εξηγεί ακόμη και την τάση του μυρμηκικού οξέος να σχηματίζει και κατάσταση υπέρψυχρου υγρού.
Χημικές ιδιότητες και παράγωγα
Επεξεργασία΄Οξινος χαρακτήρας και καρβονικά άλατα
ΕπεξεργασίαΤο μυρμηκικό οξύ είναι ένα ασθενές μονοβασικό οξύ (pKa = 4,8), ασθενέστερο από τα περισσότερα ανόργανα οξέα. Το μη καρβοξυλικό υδρογόνο δεν αντικαθίσταται από μέταλλα, αλλά παρ' όλα αυτά το μυρμηκικό οξύ αντιδρά με ορισμένα μέταλλα μέταλλα και βάσεις σχηματίζοντας άλατα με σύγχρονη παραγωγή υδρογόνου ή νερού αντίστοιχα[24]:
(Αντίδραση διάστασης)
(Επίδραση μετάλλων ηλεκτροθετικότερων του υδρογόνου)
(Αντίδραση εξουδετέρωσης)
Αποκαρβοξυλίωση
Επεξεργασία1. Με θέρμανση μυρμηκικού νατρίου παίρνουμε διοξείδιο του άνθρακα και υδρογόνο[25]:
2. Με ηλεκτρόλυση μυρμηκικού νατρίου (μέθοδος Kolbe), παράγονται διοξείδιο του άνθρακα και υδρογόνο[26]:
3. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο) παράγεται μεθανάλη[27]:
4. Με επίδραση βρωμίου σε μυρμηκικό άργυρο παράγεται υδροβρώμιο. Εφαρμογή αντίδρασης Hunsdiecker[28]:
Αναγωγή
ΕπεξεργασίαΤo μυρμηκικό οξύ ανάγεται με λιθιοαργιλιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4) προς μεθανόλη[29]:
Οξείδωση
Επεξεργασία1. Τo μυρμηκικό οξύ οξειδώνεται σε μυρμηκικό υπεροξύ από το υπεροξείδιο του υδρογόνου (H2O2), σε όξινο περιβάλλον[30]:
2. Τo μυρμηκικό οξύ οξειδώνεται σε διοξείδιο του άνθρακα (CO2)[31]:
Διάσπαση
Επεξεργασία1. Με θερμανση μυρμηκικού οξέος:
2. Με επίδραση θειικού οξέος:
- Μια συνέπεια της παραπάνω είναι η αντίδραση Koch. Π.χ:
3. Με παρουσία λευκόχρυσου (Pt) ή ρουθηνίου (Ru)[32][33]:
Εστεροποίηση
Επεξεργασία
Αλογόνωση
Επεξεργασία- Με επίδραση αλογονωτικών μέσων παράγονται φορμυλοαλογονίδια[34]:
- 1. Με SOCl2:
- 2. Με PCl5:
- 3. Με PX3:
- Για το φορμυλοφθορίδιο προτιμάται η υποκατάσταση σε φορμυλοχλωρίδιο:
Προσθήκη σε αλκένια
ΕπεξεργασίαΤο μυρμηκικό οξύ είναι το μόνο καρβοξυλικό οξύ που δίνει αντιδράσεις προσθήκης σε αλκένια παράγοτας εστέρες του. Π.χ.:
Επίδραση καρβενίων
ΕπεξεργασίαΜε επίδραση καρβενίων παράγεται ένα μίγμα προϊόντων. Π.χ. με μεθυλένιο έχουμε περίπου την παρακάτω στοιχειομετρική εξίσωση:
- Η παραπάνω στοιχειομετρική εξίσωση είναι άθροισμα κατά μέλη των ακόλουθων δράσεων:
- Παρεμβολή στον ένα (1) δεσμό C-H. Παράγεται αιθανικό οξύ, ένα καρβονικό οξύ.
- Παρεμβολή στον ένα (1) δεσμό O-H. Παράγεται μυρμηκικός μεθυλεστέρας, ο μεθυλεστέρας του μυρμηκικού οξέος.
- Προσθήκη στον ένα (1) δεσμό C=O. Παράγεται οξιρανόλη, μια ετεροκυκλική αλκοόλη.
- Συνολικά δηλαδή τρία (3) παράγωγα προϊόντα, που είναι πρακτικά ισοδύναμα (σ' αυτήν την περίπτωση) σε παραγωγή, εξαιτίας της μεγάλης δραστικότητας του μεθυλενίου, που ως δίριζα κάνει σχεδόν απόλυτα κινητικές (δηλαδή όχι εκλεκτικές) τις αντιδράσεις του.
Εφαρμογές
ΕπεξεργασίαΜια κύρια εφαρμογή του μυρμηκικού οξέος είναι ως συντηρητικό και αντιβακτηριδιακό πρόσθετο σε ζωοτροφές. Στην Ευρώπη, χρησιμοποιήθηκε στην ενσίρωση για να προωθήσει τη ζύμωση του γαλακτικού οξέος και να παρεμποδίσει τη ζύμωση του βουτανικού οξέος. Ακόμη επιτρέπει η επιθυμητή ζύμωση να γίνει γρήγορα, και σε χαμηλώτερη θερμοκρασία, μειώνοντας έτσι την απώλεια σε διατροφική αξία[7]. Το μυρμηκικό οξύ παρεμποδίζει αρκετές διεργασίες αποσύνθεσης και έτσι η χρήση του έχει ως αποτέλεσμα τη διατήρηση της διατροφικής αξίας της ζωοτροφής για μακρύτερο χρονικό διάστημα, οπότε χρησιμοποιείται ευρύτατα για τη συντήρηση της χειμερινής ζωοτροφής για βοειδή. Στην πτηνοτροφία, μερικές φορές προστίθεται στη ζωοτροφή τους για να θανατώσει Εσερίχια κόλι (E. coli) βακτήρια[35][36]
Η χρήση του μυρμηκικού οξέος ως συντηριτικό στην ενσίρωση και σε άλλες ζωοτροφές συνεισέφερε κατά περίπου το 30% στην παγκόσμια κατανάλωση μυρμηκικού οξέος το 2009[5].
Το μυρμηκικό οξύ χρησιμοποιήθηκε επίσης σημαντικά στην παραγωγή του δέρματος, που περιλαμβάνει τη δέψη (23% της παγκόσμιας κατανάλωσης μυρμηκικού οξέος το 2009[5]), καθώς και στη βαφή και το φινίρισμα των υφασμάτων (9% της παγκόσμιας κατανάλωσης μυρμηκικού οξέος το 2009[5]), εξαιτίας της όξινης φύσης του. Χρησιμοποιήθηκε ως πηκτικό στην παραγωγή του καοτσούκ[7] (6% της παγκόσμιας κατανάλωσης μυρμηκικού οξέος το 2009[5]).
Το μυρμηκικό οξύ χρησιμοποιήθηκε στη θέση των ορυκτών οξέων σε διάφορα καθαριστικά προϊόντα[7], όπως αποσκληρηντικά και καθαριστικά σιφωνιού τουαλέττας. Κάποιοι μυρμηκικοί εστέρες χρησιμοποιούνται ως τεχνητά αρωματικά πρόσθετα τροφίμων ή και ποτών, ακόμη και ως αρώματα. Οι μελισσοκόμοι χρησιμοποίησαν μυρμηκικό οξύ ως ακαρεοκτόνο εναντίον των ακάρεων της τραχείας (Acarapis woodi) και του βαρρόα.[37]. Η χρήση του μυρμηκικού οξέος σε κυψέλες καυσίμων βρίσκεται ακόμη στο στάδιο της έρευνας[38].
Στα ανθρώπινα τρόφιμα χρησιμοποιήθηκε για την εξάλειψη των βακτηρίων της σαλμονέλας. Στα τρόφιμα, αν και όταν χρησιμοποιείται μυρμηκικό οξύ, αναγράφεται με τον κωδικό Ε 236.
Εργαστηριακή χρήση
ΕπεξεργασίαΤο μυρμηκικό οξύ αποτελεί πηγή για τη φορμυλομάδα (HCO), για παράδειγμα για τη φορμυλίωση της τολουϊδίνης για την παραγωγή N-φορμυλοτολουϊδίνης με διαλύτη τολουόλιο[39]. Στη συνθετική οργανική χημεία, το μυρμηκικό οξύ συχνά χρησιμοποιείται και ως πηγή ιόντος υδριδίου (H-). Η αντίδραση Εσχγουέιλερ-Κλαρκέ (Eschweiler-Clarke reaction) και η αντίδραση Λευκάρτ-Γουάλλας (Leuckart-Wallach) αποτελούν παραδείγματα για αυτήν την εφαρμογή. Το μυρμηκικό οξύ ή πιο συχνά το αζεοτροπικό μίγμα του με τη τριαιθυλαμίνη, χρησιμοποιήθηκε επίσης ως πηγή υδρογόνου σε μεταφορική υδρογόνωση.
Όπως το αιθανικό οξύ και το τριφθοραιθανικό οξύ, το μυρμηκικό οξύ επίσης χρησιμοποιήθηκε συχνά ως πτητικός ρυθμιστής pH σε υγρή χρωματογραφία υψηλής απόδοσης (HPLC) και σε τριχοειδή ηλεκτροφόρηση
Όπως αναφέρεται και πιο κάτω, το μυρμηκικό οξύ μπορεί να χρησιμεύσει ως βολική πηγή μονοξειδίου του άνθρακα, αφού μπορεί να αποικοδομηθεί γρήγορα από το θειικό οξύ.
Άλλες εφαρμογές
Επεξεργασία- Χρησιμοποιείται στην κατεργασία του φυσικού καουτσούκ.
- Χρησιμοποιείται στη μελισσοκομία.
- Χρησιμοποιείται σε μικρή κλίμακα στην υφαντουργία και στη βυρσοδεψία.
- Κάποιοι εστέρες του χρησιμοποιούνται ως αιθέρια έλαια, προσθετικά αρώματος τροφίμων και μη, καθώς και στην αρωματοποιία.
- Χρησιμοποιείται στην παρασκευή κάποιων οικιακών καθαριστικών αλάτων.
- Χρησιμοποιείται σε εργαστήρια ως διαλυτικό μέσο για διαχωρισμούς μέσω HPLC και CE πρωτεϊνών, πεπτιδίων και ιδιαίτερα για προπαρασκευή για αναλύσεις φασματοσκοπίας μάζας.
- Έχει αναφερθεί η κατασκευή κυψελών καυσίμου που αξιοποιούν μυρμηκικό οξύ.
Ασφάλεια
ΕπεξεργασίαΤο διάλυμα μυρμηκικού οξέος 85% είναι αναφλέξιμο και το διάλυμά του βρίσκεται στη λίστα της Διεύθυνσης Τροφίμων και Φαρμάκων των ΗΠΑ ως προσθετικό τροφίμων[40]. Οι κύριοι κίνδυνοι από το μυρμηκικό οξύ είναι από την επαφή του με το δέρμα και τα μάτια, σε μορφή υγρή ή ατμών του. Σύμφωνα με τον OSHA των ΗΠΑ το επιτρεπόμενο επίπεδο έκθεσης σε ατμούς μυρμηκικού οξέος σε εργασιακό περιβάλλον είναι 5 ppm.
Το μυρμηκικό οξύ μεταβολίζεται και εξουδετερώνεται από το ανθρώπινο σώμα. Ωστόσο έχει ειδικές τοξικές συνέπειες: Το μυρμηκικό οξύ και η μεθανάλη παράγονται ως μετάβολίτες της μεθανόλης και είναι υπεύθυνα για βλάβες στα οπτικά νεύρα, μέχρι του σημείου της τύφλωσης[41]. Επίσης και κάποιες χρόνιες συνέπειες της έκθεσης σε μυρμηκικό οξύ έχουν τεκμηριωθεί. Σχετικά πειράματα σε ζώα έδειξαν ότι η χρόνια έκθεση σε μυρμηκικό οξύ μπορεί να προκαλέσει βλάβες στο συκώτι και στα νεφρά. Μια άλλη συνέπεια της χρόνιας έκθεσης στο μυρμηκικό οξύ είναι η ανάπτυξη μιας δερμικής αλλεργικής αντίδρασης σε κάθε επανέκθεση σ' αυτό.
Το πυκνό μυρμηκικό οξύ αυτοδιασπάται αργά προς μονοξείδιο του άνθρακα (CO) και νερό (H2O), οδηγώντας σε αύξηση της πίεσης στο δοχείο όπου έχει αποθηκευθεί. Για το σκοπό αυτό το 98% μυρμηκικό οξύ αποθηκεύεται σε πλαστικά δοχεία με καπάκια που έχουν βαλβίδες ασφαλείας εκτόνωσης αερίων.
Οι κίνδυνοι από διάφορα διαλύματα μυρμηκικού οξέος εξαρτώνται από τη συγκέντρωσή του. Ακολουθεί ένας σχετικός πίνακας με την ταξινόμηση της Ευρωπαϊκής Ένωσης για την επικινδυνότητα των διαλυμάτων του μυρμηκικού οξέος:
| Συγκέντρωση (% κατά βάρος) | Ταξινόμηση | Φράση-R |
|---|---|---|
| 2%–10% | Ερεθιστικό (Xi) | R36/38 |
| 10%–90% | Διαβρωτικό (C) | R34 |
| >90% | Διαβρωτικό (C) | R35 |
Η ανάλυση για μυρμηκικό οξύ σε σωματικά υγρά σχεδιάστηκε για τον προσδιορισμό, μέσω των φορμικών ιόντων (HCOO-), της τυχόν δηλητηρίασης από μεθανόλης, με βάση την αντίδραση των φορμικών με τη χρήση βακτηριαής δεϋδρογονάση των φορμικών[15].
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Για εναλλακτικές ονομασίες δείτε τον πίνακα πληροφοριών.
- ↑ New study confirms that nature is responsible for 90% of the Earth's atmospheric acidity – wattsupwiththat.com
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 S.N. Bizzari· M. Blagoev (Ιούνιος 2010). «CEH Marketing Research Report: FORMIC ACID». Chemical Economics Handbook. SRI consulting. Ανακτήθηκε στις 1 Ιουλίου 2011.
- ↑ Δηλ. βάρος κατά βάρος
- ↑ 7,0 7,1 7,2 7,3 Werner Reutemann and Heinz Kieczka “Formic Acid” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim.
- ↑ Roman M. Balabin (2009). «Polar (Acyclic) Isomer of Formic Acid Dimer: Gas-Phase Raman Spectroscopy Study and Thermodynamic Parameters». J. Phys. Chem. A 113 (17): 4910–4918. doi:. PMID 19344174.
- ↑ Werner Reutemann and Heinz Kieczka "Formic Acid" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim.
- ↑ P. G. Jessop, in Handbook of Homogeneous Hydrogenation (Eds.: J. G. de Vries, C. J. Elsevier), Wiley-VCH, Weinheim, Germany, 2007, pp. 489–511.
- ↑ P. G. Jessop, F. Joó, C.-C. Tai (2004). "Recent advances in the homogeneous hydrogenation of carbon dioxide". Coord. Chem. Rev. 248 (21–24): 2425. doi:10.1016/j.ccr.2004.05.019.
- ↑ R. Wölfel, N. Taccardi, A. Bösmann, P. Wasserscheid (2011). "Selective catalytic conversion of biobased carbohydrates to formic acid using molecular oxygen". Green Chem. (13): 2759. doi:10.1039/C1GC15434F.
- ↑ J. Albert, R. Wölfel, A. Bösmann, P. Wasserscheid (2012). "Selective oxidation of complex, water-insoluble biomass to formic acid using additives as reaction accelerators". Energy Environ. Sci. (5): 7956. doi:10.1039/C2EE21428H.
- ↑ Chattaway, F. D. (1914). "Interaction of glycerol and oxalic acid". Journal of the Chemical Society, Transactions 105: 151–156. doi:10.1039/CT9140500151. Available at HathiTrust.
- ↑ 15,0 15,1 Makar AB, McMartin KE, Palese M, Tephly TR (1975). "Formate assay in body fluids: application in methanol poisoning". Biochem Med 13 (2): 117–26. doi:10.1016/0006-2944(75)90147-7. PMID 1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.2.
- ↑ 17,0 17,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3α.
- ↑ 19,0 19,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.6α.
- ↑ Werner Reutemann and Heinz Kieczka “Formic Acid” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_013
- ↑ OSHA description Αρχειοθετήθηκε 2011-09-20 στο Wayback Machine..
- ↑ Werner Reutemann and Heinz Kieczka “Formic Acid” in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a12_013.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.5β.
- ↑ C. Fellay, P. J. Dyson, G. Laurenczy, A Viable Hydrogen-Storage System Based On Selective Formic Acid Decomposition with a Ruthenium Catalyst, Angew. Chem. Int. Ed., 2008, 47, 3966–3970.
- ↑ G. Laurenczy, C. Fellay, P. J. Dyson, Hydrogen production from formic acid. PCT Int. Appl. (2008), 36pp. CODEN: PIXXD2 WO 2008047312 A1 20080424 AN 2008:502691
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.
- ↑ Griggs, J. P.; J (2005). "Alternatives to Antibiotics for Organic Poultry Production". The Journal of Applied Poultry Research 14 (4): 750.
- ↑ Garcia, V.; Catala-Gregori, P.; Hernandez, F.; Megias, M. D.; Madrid, J. (2007). "Effect of Formic Acid and Plant Extracts on Growth, Nutrient Digestibility, Intestine Mucosa Morphology, and Meat Yield of Broilers". The Journal of Applied Poultry Research 16 (4): 555. doi:10.3382/japr.2006-00116.
- ↑ http://www.biobees.com/library/pesticides_GM_threats/miticides_varroa_acarapis.pdf[νεκρός σύνδεσμος]
- ↑ Ha, S.; Larsen, R.; Masel, R. I. (2005). "Performance characterization of Pd/C nanocatalyst for direct formic acid fuel cells". Journal of Power Sources 144 (1): 28–34. doi:10.1016/j.jpowsour.2004.12.031.
- ↑ L. F. Fieser and J. E. Jones (1955), Org. Synth., http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=cv3p0590 Αρχειοθετήθηκε 2011-06-05 στο Wayback Machine. ; Coll. Vol. 3: 590
- ↑ US Code of Federal Regulations: 21 CFR 186.1316, 21 CFR 172.515
- ↑ "Methanol and Blindness". Ask A Scientist, Chemistry Archive. http://www.newton.dep.anl.gov/askasci/chem03/chem03561.htm Αρχειοθετήθηκε 2013-06-27 στο Wayback Machine.. Retrieved 22 May 2007.
Πηγές
Επεξεργασία- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
