Διπολική ροπή δεσμού
Η διπολική ροπή δεσμού χρησιμοποιεί την ιδέα της ηλεκτρικής διπολικής ροπής για να μετρήσει την χημική πολικότητα ενός χημικού δεσμού μέσα σε ένα μόριο. Συμβαίνει όποτε υπάρχει ένας διαχωρισμός θετικών και αρνητικών φορτίων. Το bond dipole μ δίνεται από:
- .
Το δίπολο δεσμού προτυποποιείται ως +δ — δ- με μια απόσταση d μεταξύ των μερικών φορτίων +δ και δ-. Είναι ένα διάνυσμα, παράλληλο προς τον άξονα των δεσμών, που δείχνει από το συν στο πλην , όπως είναι συμβατικά[1] για διανύσματα ηλεκτρικής διπολικής ροπής. (Μερικοί χημικοί σχεδιάζουν το διάνυσμα να δείχνει από το συν στο πλην, αλλά μόνο σε περιπτώσεις όπου η κατεύθυνση δεν είναι σημαντική.)[1] Αυτό το διάνυσμα μπορεί να ερμηνευτεί φυσικά ως η κίνηση που υφίστανται από τα ηλεκτρόνια όταν τα δύο άτομα τοποθετούνται σε απόσταση d μεταξύ τους και τους επιτρέπεται να αλληλεπιδράσουν, τότε τα ηλεκτρόνια θα μετακινηθούν από τις θέσεις ελεύθερης κατάστασης τους σε πιο εντοπισμένες γύρω από το πιο ηλεκτραρνητικό άτομο.
Η μονάδα SI για την ηλεκτρική διπολική ροπή είναι coulomb-meter. Αυτή είναι υπερβολικά μεγάλη για να είναι πρακτική στη μοριακή κλίμακα. Οι διπολικές ροπές δεσμού μετρώνται συνήθως σε debye, που συμβολίζονται με D και λαμβάνονται μετρώντας το φορτίο σε μονάδες του 10−10 statcoulomb και η απόσταση d σε Ώνγκστρεμ. Σημειώστε ότι 10−10 statcoulomb είναι 0,208 μονάδες στοιχειώδους φορτίου, έτσι 1,0 debye προέρχεται από ένα ηλεκτρόνιο και ένα πρωτόνιο που απέχουν 0,208 Angstrom. Ένας άλλος χρήσιμος συντελεστής μετατροπής είναι 1 C m = 2,9979 × 1029 D.
Για διατομικά μόρια υπάρχει μόνο ένας (απλός ή πολλαπλός) δεσμός , έτσι ώστε η διπολική ροπή δεσμού να είναι η μοριακή διπολική ροπή, με τυπικές τιμές στην περιοχή των 0 έως 11 D. Στο ένα άκρο, ένα συμμετρικό μόριο όπως το χλώριο, Cl2, έχει μηδενική διπολική ροπή, ενώ κοντά στο άλλο άκρο, η αέρια φάση του βρωμιούχου καλίου, KBr, που είναι εξόχως ιονικό, έχει μια διπολική ροπή των 10.5 D.[2]
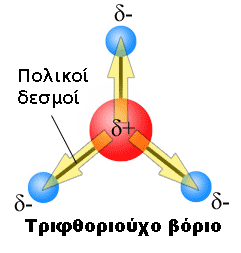
Για πολυατομικά μόρια υπάρχουν περισσότεροι από έναν δεσμό και η συνολική μοριακή διπολική ροπή μπορεί να προσεγγιστεί ως το διανυσματικό άθροισμα των μεμονωμένων διπολικών ροπών των δεσμών. Συχνά τα δίπολα δεσμού λαμβάνονται με την αντίστροφη διεργασία: ένα γνωστό συνολικό δίπολο ενός μορίου μπορεί να αποσυντεθεί σε δίπολα δεσμού. Αυτό γίνεται για να μεταφερθούν οι διπολικές ροπές δεσμού στα μόρια που έχουν τους ίδιους δεσμούς, αλλά για τα οποία η συνολική διπολική ροπή δεν είναι ακόμα γνωστή. Το διανυσματικό άθροισμα των μεταφερόμενων διπόλων δεσμού δίνει μια εκτίμηση για το συνολικό (άγνωστο) δίπολο του μορίου.
Το δίπολο δεσμού είναι δύο άτομα σε έναν δεσμό, τέτοια ώστε η ηλεκτραρνητικότητα του ενός ατόμου να προκαλεί μεταφορά ηλεκτρονίων προς το άλλο, προκαλώντας ένα μερικό αρνητικό φορτίο. Υπάρχει συνεπώς μια διαφορά στην πολικότητα κατά μήκος του δεσμού, που προκαλεί μια διπολική ροπή.
Παραπομπές
Επεξεργασία- ↑ 1,0 1,1 The Electric Dipole Moment Vector : Direction,Magnitude, Meaning, Etc.
- ↑ Physical chemistry 2d Edition (1966) G.M. Barrow McGraw Hill

