Καρβαμικό οξύ
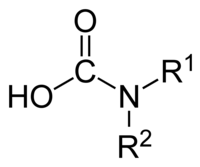
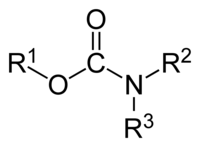
Το καρβαμικό οξύ, με σύντομο συντακτικό τύπο H2NCOOH, είναι μια οργανική χημική ένωση που είναι ασταθής υπό κανονικές συνθήκες. Δεν είναι το απλούστερο αμινοξύ, όπως τυπικά φαίνεται, αλλά το μονοαμίδιο του ανθρακικού οξέος, του οποίου διαμίδιο αποτελεί η ουρία, γιατί η αμινομάδα (NH2) του είναι άμεσα συνδεμένη με καρβονύλιο (C=O), γεγονός που ορίζει το καρβαμικό οξύ ως αμίδιο. Η σημασία του βρίσκεται περισσότερο στο ότι αποτελεί την τυπική μητρική ένωση που ορίζει τα μονοαλκυλο[1] και διαλκυλο παράγωγά του, που περιγράφονται με τη γενική ονομαασία «καρβαμικά οξέα», καθώς και τους αντίστοιχους εστέρες τους[2]:
| Καρβαμικό οξύ | |
|---|---|

| |

| |
| Γενικά | |
| Όνομα IUPAC | Καρβαμικό οξύ |
| Χημικά αναγνωριστικά | |
| Χημικός τύπος | CH3NO2 |
| Μοριακή μάζα | 61,040 amu |
| Σύντομος συντακτικός τύπος |
H2NCOOH |
| Αριθμός CAS | 56-40-6 |
| SMILES | O=C(O)N |
| InChI | 1S/CH3NO2/c2-1(3)4/h2H2,(H,3,4) |
| PubChem CID | 277 |
| ChemSpider ID | 271 |
| Ισομέρεια | |
| Ισομερή θέσης | 11 |
| Φυσικές ιδιότητες | |
| Χημικές ιδιότητες | |
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |
Η μονοσθενής ρίζα H2NCO ονομάζεται «καρβαμύλιο». Οι καρβαμούλοτρανσφεράσες είναι ειδικά ένζυμα με γενικό κωδικό 2.1.3.x και έχουν την ειδική λειτουργία να μεταφέρουν καρβαμύλομάδες και παράγωγά τους από μια ένωση σε μια άλλη. Τα καρβαμικά οξέα είναι ενδιάμεσα στην αποικοδόμηση των «προστατευμένων»[3] εστέρων τους. Η υδρόλυση ενός τέτοιου εστέρα συνεπάγεται την παραγωγή απροστάτευτων καρβαμικών οξέων, που με τη σειρά του αυτοδιασπούνται σύντομα σε διοξείδιο του άνθρακα και αμμωνία ή την αντίστοιχη αμίνη.
Το καρβαμικό οξύ είναι ένα σημαντικό μόριο στους ζωντανών οργανισμών[4] που το παράγουν ενζυμικά από την ουρία.
Ισομέρεια
ΕπεξεργασίαΜε βάση το χημικό τύπο της, CH3NO2, έχει τα ακόλουθα 11 ισομερή θέσης:
- Νιτρομεθάνιο με σύντομο συντακτικό τύπο: CH3NO2
- Νιτρώδης μεθυλεστέρας με σύντομο συντακτικό τύπο: CH3ONO (ο μεθυλεστέρας του νιτρώδους οξέος).
- Υδροξιμινομεθανόλη με σύντομο συντακτικό τύπο: HON=CHOH.
- Νιτρωδομεθανόλη με σύντομο συντακτικό τύπο: ONCH2OH.
- Μεθανοϋδροξαμίδιο με σύντομο συντακτικό τύπο: HCONHOH
- 1,2,3-διοξαζετιδίνη με σύντομο συντακτικό τύπο: .
- 1,3,2-διοξαζετιδίνη με σύντομο συντακτικό τύπο: .
- 3-υδροξυ-1,2-οξαζιριδίνη με σύντομο συντακτικό τύπο: .
- Ν-υδροξυ-1,2-οξαζιριδίνη με σύντομο συντακτικό τύπο: .
- Αμινοδιοξιράνιο με σύντομο συντακτικό τύπο: .
- N-μεθυλοδιοξαζιριδίνη με σύντομο συντακτικό τύπο: .
Δομή
Επεξεργασία| Δεσμοί[5] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C-H | σ | 2sp3-1s | 109 pm | 3% C- H+ |
| C-N | σ | 2sp2-2sp3 | 149 pm | 6% C+ Ν- |
| Ν-H | σ | 2sp3-1s | 101,7 pm | 17% N- H+ |
| C=O | σ | 2sp2-2sp2 | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp2-2sp3 | 147 pm | 19% C+ O- |
| O-H | σ | 2sp3-1s | 96 pm | 32% O- H+ |
| Κατανομή φορτίων σε ουδέτερο μόριο | ||||
| -O | -0,51 | |||
| =O | -0,38 | |||
| -N | -0,28 | |||
| H(NH2) | +0,17 | |||
| H(OH) | +0,32 | |||
| C | +0,63 | |||
Παραγωγή
Επεξεργασία- Απαιτείται ρύθμιση του pH στο pI για να επιτευχθεί η κρυστάλλωσή του σε καθαρή μορφή.
1. Από αλομεθανικό οξύ:
- α. Με επίδραση αμμωνίας:
- β. Μέσω οργανομαγνησιακών ενώσεων και αλαμίνης με εστεροποίηση για προστασία της καρβοξυλομάδας:
- Το XCOOH είναι μονοαλογονίδιο του ανθρακικού οξέος. Μπορεί λοιπόν να παραχθεί με επίδραση αλογογονωτικών μέσων σε αυτό. Π.χ.:
2. Από νιτρομεθανικό οξύ με αναγωγή:
- Το O2NCOOH μπορεί να παραχθεί με επίδραση AgNO2 σε XCOOH:
3. Από οξαλικό οξύ με μετροπή σε μονοαμίδιο και αποικοδόμηση - μετάθεση Hofmann:
4. Από κυαναμίδιο με υδρόλυση:
- Το NH2CN μπορεί να παραχθεί με επίδραση NaCN σε αλαμίνη:
- Η NH2X μπορεί να παραχθεί από την αμμωνία ως εξής:
Χημικές ιδιότητες και παράγωγα
Επεξεργασία1. Ιονισμός:
- Σε υδατικά διαλύματα:
- Για pH<pK1 ιονίζεται η αμινομάδα (αριστερά).
- Για pH=pI ιονίζονται και η αμινομάδα και η καρβοξυλομάδα (κέντρο).
- Για pH>pK2 ιονίζεται μόνο η καρβοξυλομάδα (δεξιά).
2. Παραγωγή αλάτων με οξέα και βάσεις. Π.χ.:
και
3. Εστεροποίηση:
4. Επίδραση αλκυλοαλογονιδίων:
5. Επίδραση ακυλοαλογονιδίων:
6. Επίδραση καρβενίων. Π.χ. μεθυλενίου:
7. Αυτοδιάσπαση:
Αναφορές και σημειώσεις
Επεξεργασία- ↑ Με την «πλατιά» έννοια «αλκυλο», δηλαδή οποιαδήποτε οργανική ρίζα.
- ↑ Thomas L. Lemke. (2003). Review of organic functional groups : introduction to medicinal organic chemistry. Philadelphia, Pa.: Lippincott Williams & Wilkins. σελ. 63. ISBN 9780781743815.
- ↑ Η εστεροποίηση οξέων είναι μια μέθοδος «προστασίας» τους από ανεπιθύμητες αντιδράσεις.
- ↑ R.K. Khanna, M.H. Moore. (1998). «A 55». Carbamic acid: molecular structure and IR spectra (pii: S1386-1425(98)00228-5) (PDF). Greenbelt, MD.: Elsevier. σελίδες 961–967.
- ↑ Τα δεδομένα προέρχονται εν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34. Οι ηλεκτραρνητικότητες κατά Pauling, από τις οποίες υπολογίστηκε ο ιονισμός, προέρχονται από τους πίνακες δεδομένων των χημικών στοιχείων άνθρακας, υδρογόνο, οξυγόνο και άζωτο.
Πηγές
Επεξεργασία- SCHAUM'S OUTLINE SERIES, «ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ», Μτφ. Α. Βάρβογλη, 1999
- «Ασκήσεις και προβλήματα Οργανικής Χημείας» Ν. Α. Πετάση 1982
- Αναστάσιου Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991
- Καραγκιοζίδη Σ. Πολυχρόνη, «Ονοματολογία Οργανικών Ενώσεων στα Ελληνικά & Αγγλικά» Β΄ ΈκδοσηΘεσσαλονίκη 1991
- Νικολάου Ε. Αλεξάνδρου, «Γενική Οργανική Χημεία», Εκδόσεις Ζήτη, Θεσσαλονίκη 1985
- Δημητρίου Ν. Νικολαΐδη, «Ειδικά Μαθήματα Οργανικής Χημείας», ΑΠΘ, θεσσαλονίκη 1983
- Νικολάου Ε. Αλεξάνδρου, Αναστάσιου Βάρβογλη, Φαίδωνα Χατζημηχαλάκη, «Εργαστηριακός Οδηγός», Εκδόσεις Ζήτη, Θεσσαλονίκη 1986
- Διαδικτυακοί τόποι που αναφέρονται στις «Αναφορές και παρατηρήσεις».